
| A、Fe3++3H2O═Fe(OH)3+3H+ |
| B、HSO3-+H2O?H2SO3+OH- |
| C、CH3COO-+H2O?CH3COOH+OH- |
| D、A13++3HCO3-═Al(OH)3↓+3CO2↑ |


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
| A、4g 氦气中含有的分子数为NA |
| B、常温常压下,22.4 L Cl2中含有的分子数为NA |
| C、1 L 1 mol/L K2SO4溶液中含有的钾离子数为NA |
| D、1 mol钠原子中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
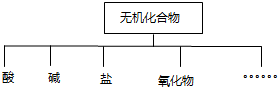
| 物质 类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
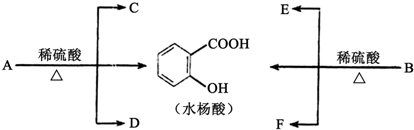
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物中n(Fe):n(Fe2O3)=2:1 |
| B、向溶液中滴入KSCN溶液,显红色 |
| C、无法计算原混合物的质量a |
| D、此时溶液中Fe2+和Fe3+的物质的量之比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 操作 | 现象 |
| I | 向2mL 1mol?L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色. |
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A元素在周期表中的位置是第六周期第ⅠA族 |
| B、单质A性质稳定 |
| C、A元素的最高价氧化物的水化物是一种强碱 |
| D、A有多种氧化物,但均不与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4=2H++S6++4O2- |
| B、AlCl3=Al3++Cl3- |
| C、Ba(OH)2=Ba2++2OH- |
| D、Na2CO3=Na2++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com