
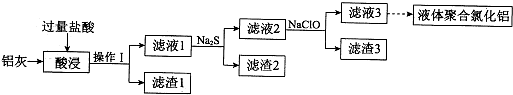
分析 铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)加过量盐酸,过滤滤渣1为SiO2,滤液1中含有Al3+、Fe3+、Fe2+、Cu2+等,滤液中加硫化钠,Cu2+转化为CuS沉淀;过滤,滤液2中加NaClO把亚铁离子氧化为铁离子,铁离子易水解生成氢氧化铁沉淀,过滤,滤液3中为氯化铝;
(1)Al2O3与盐酸反应生成氯化铝和水;
(2)上述分析可知,滤渣1为二氧化硅,铜离子与硫离子结合生成CuS沉淀;
(3)亚铁离子被NaClO氧化为铁离子,铁离子易水解生成氢氧化铁沉淀;
(4)AlCl3水解生成Alm(OH)nCl3m-n和HCl,根据原子守恒配平方程式;
(5)硫化钠是强碱弱酸盐,溶液中硫离子分步水解溶液显碱性,溶液中存在电荷守恒、物料守恒.
解答 解:铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)加过量盐酸,过滤滤渣1为SiO2,滤液1中含有Al3+、Fe3+、Fe2+、Cu2+等,滤液中加硫化钠,Cu2+转化为CuS沉淀;过滤,滤液2中加NaClO把亚铁离子氧化为铁离子,铁离子易水解生成氢氧化铁沉淀,过滤,滤液3中为氯化铝;
(1)Al2O3与盐酸反应生成氯化铝和水,其反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
(2)铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)溶于盐酸后,二氧化硅不和盐酸发生反应,过滤得到滤渣1为二氧化硅,溶液中含有铜离子,加入硫化钠,生成CuS黑色沉淀,故答案为:SiO2;CuS;
(3)向滤液2中含有亚铁离子,加入NaClO溶液,亚铁离子被NaClO氧化为铁离子,铁离子易水解生成氢氧化铁沉淀,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O、Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO;
故答案为:将Fe2+氧化为Fe3+,使Fe3+转化为Fe(OH)3沉淀;2Fe2++ClO-+2H+=2Fe3++Cl-+H2O、Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO;
(4)AlCl3水解生成Alm(OH)nCl3m-n和HCl,根据原子守恒配平方程式为:mAlCl3+nH2O=Alm(OH)nCl3m-n+nHCl;
故答案为:mAlCl3+nH2O=Alm(OH)nCl3m-n+nHCl;
(5)Na2S溶液呈碱性的原因是硫化钠是强碱弱酸盐,溶液中硫离子分步水解溶液显碱性,离子方程式:S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-;溶液中存在电荷守恒为:2c(S2-)+c(HS-)+c(OH-)=c(Na+)+c(H+),c(Na+)=2c(S2-)+c(HS-)+c(OH-)-c(H+),物料守恒n(Na)=2n(S),c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),
故答案为:S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-;2c(S2-)+2c(HS-)+2c(H2S)或2c(S2-)+c(HS-)+c(OH-)-c(H+).
点评 本题是一道关于物质的分离和提纯知识的实验操作题,涉及基本实验操作、沉淀的生成、氧化还原反应、电解质溶液中,盐类水解、电荷守恒和物料守恒的应用等,侧重于考查学生分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 0 | 0.20 | 0.60 | 0 |
| 10 | a1 | a2 | 0.25 |
| 13 | b1 | 0.45 | b2 |
| 15 | d1 | d2 | 0.30 |
| A. | 前10 min内的平均反应速率v(Y)=2.5×10-3 mol/(L•min) | |
| B. | 保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10-3 mol/L | |
| C. | 若起始时只充入0.60 mol Z(g),反应达平衡时Z(g)的转化率为50% | |
| D. | 若起始时充入0.60 mol X(g)、0.10 mol Y(g)和0.50 mol Z(g),达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | |
| B. | 物质的量 C:CuO:Fe=3:2:2 | |
| C. | 质量 MnO2:CuO:C=5.5:8:1.2 | |
| D. | 质量 Fe:C:CuO=7:5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳氧化物的转化有重大用途,回答关于CO和CO2的问题.
碳氧化物的转化有重大用途,回答关于CO和CO2的问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向其中加入50g蒸馏水 | |
| B. | 操作步骤是计算、量取、混匀、装瓶贴标签 | |
| C. | 必须使用的玻璃仪器是烧杯、量筒、玻璃棒 | |
| D. | 若量取水时俯视读数,所配溶液的溶质质量分数偏大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com