
| A. | Na2O→NaOH | B. | Fe→FeCl2 | C. | CuO→Cu | D. | H2O2→H2O |
分析 氧化剂具有氧化性,在反应中得到电子而被还原,如题中物质被氧化,则所含元素的化合价应升高,以此解答该题.
解答 解:A.Na2O→NaOH,元素化合价没有发生变化,不是氧化还原反应,故A错误;
B.Fe→FeCl2,Fe元素化合价升高,被氧化,应加入氧化剂才能实现,故B正确;
C.CuO→Cu,Cu元素化合价降低,被还原,应加入还原剂,故C错误;
D.H2O2→H2O,O元素的化合价降低,但是H2O2自身分解,H2O2既是氧化剂又是还原剂,所以不需要氧化剂,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考常见题型,难度不大,注意从元素化合价的角度解答该类题目.


科目:高中化学 来源: 题型:解答题
 ,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.
,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用甲苯的硝化反应可以制得TNT炸药 | |
| B. | 苯与甲苯互为同系物,可以用KMnO4酸性溶液进行鉴别 | |
| C. | 苯和溴水振荡后,由于发生化学反应而使溴水的水层颜色变浅 | |
| D. | 煤焦油中含有苯和甲苯,用蒸馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 1mol•L-1Mg(NO3)2 溶液 | B. | 5 mL 0.8mol•L-1 Al(NO3)3溶液 | ||
| C. | 10 mL 2mol•L-1AgNO3溶液 | D. | 10 mL 0.5mol•L-1 Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度下,在水中的溶解度Na2CO3>NaHCO3 | |
| C. | 相同质量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3 | |
| D. | Na2CO3 和NaHCO3均可与澄清石灰水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
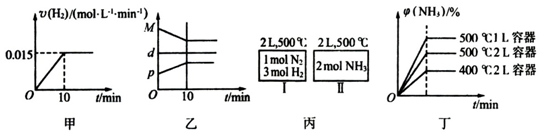
| A. | 若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 | |
| B. | 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 | |
| C. | 如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ | |
| D. | 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com