
【题目】下列溶液中微粒的物质的量浓度关系不正确的是![]()
A.若将适量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,则溶液中
溶液中至溶液恰好呈中性,则溶液中![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水电离出的![]() ,若
,若![]() 时,则该溶液pH一定为
时,则该溶液pH一定为![]()
C.常温下将相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:![]()
【答案】B
【解析】
A、依据反应过程和溶液中存在的电荷守恒分析判断;
B、常温时,某溶液中由水电离出的![]()
![]() ,若
,若![]() 时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液;
时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液;
C、碱的强弱不知,若为强酸、强碱混合,呈中性,若为强酸、弱碱混合,则相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合显碱性;
一元碱BOH溶液混合显碱性;
D、HClO是弱酸,所以NaClO溶液中发生水解反应:![]() ,使溶液呈碱性,氢离子浓度小于
,使溶液呈碱性,氢离子浓度小于![]() ,所以NaCl溶液中
,所以NaCl溶液中![]() 大于NaClO溶液中
大于NaClO溶液中![]() ,依据电荷守恒分析。
,依据电荷守恒分析。
A、将![]() 通入
通入![]()
![]() 溶液中恰好呈中性,溶液中存在电荷守恒,
溶液中恰好呈中性,溶液中存在电荷守恒,![]() ,
,![]() ,则得到
,则得到![]() ,故A正确;
,故A正确;
B.常温时,某溶液中由水电离出的![]()
![]() ,若
,若![]() 时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则
时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则![]() ,如为碱溶液,则
,如为碱溶液,则![]() ,故B错误;
,故B错误;
C、![]() 硫酸,
硫酸,![]() ,硫酸完全电离,
,硫酸完全电离,![]() 一元碱BOH,
一元碱BOH,![]() ,若为强酸、强碱混合,混合后溶液呈中性,若为强酸、弱碱混合,氢离子和氢氧根离子正好反应生成盐和水,而弱碱存在电离平衡,平衡右移,还可以继续电离出氢氧根离子,所以溶液呈碱性,故C正确;
,若为强酸、强碱混合,混合后溶液呈中性,若为强酸、弱碱混合,氢离子和氢氧根离子正好反应生成盐和水,而弱碱存在电离平衡,平衡右移,还可以继续电离出氢氧根离子,所以溶液呈碱性,故C正确;
D、HClO是弱酸,所以NaClO溶液中发生水解反应:![]() ,使溶液呈碱性,氢离子浓度小于
,使溶液呈碱性,氢离子浓度小于![]() ,所以NaCl溶液中
,所以NaCl溶液中![]() 大于NaClO溶液中
大于NaClO溶液中![]() ,根据电荷守恒:
,根据电荷守恒:![]() 可得溶液中离子总数为
可得溶液中离子总数为![]() ;同理可得NaClO溶液中总数为
;同理可得NaClO溶液中总数为![]() ,所以NaCl溶液中离子总数大于NaClO溶液,故D正确;
,所以NaCl溶液中离子总数大于NaClO溶液,故D正确;
故选:B。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
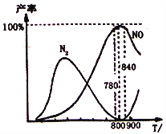
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D. 氮气氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g)△H=-181.5kJ/mol
2NO(g)△H=-181.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是( )

A.氧化性的强弱顺序为:Cl2 >IO3-- >I2
B.一定条件下, I--与IO3--反应可能生成I2
C.向含I--的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
D.途径Ⅱ中若生成1mol I2,消耗5mol NaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种,在一定条件下可与H2发生加成反应。下列关于该化合物的说法不正确的是( )
)是最简单的一种,在一定条件下可与H2发生加成反应。下列关于该化合物的说法不正确的是( )
A.与环戊烯互为同分异构体B.所有碳原子不可能处于同一平面
C.二氯代物有3种D.生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3和+6价等价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:

查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO72-。回答下列问题:
(1)滤渣D的化学式为________,溶液A中加入过量H2O2的离子方程式是_____________。
(2)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式_______________。
(3)酸化滤液D时,不选用盐酸的原因是_____________。
(4)固体E的主要成分是Na2SO4,根据如图分析操作a为蒸发浓缩、__________、洗涤、干燥。
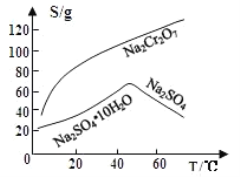
(5)已知含+6价铬的污水会污染环境,某电镀厂废水中往往含有一定量的Cr2O72-,可用下列方法进行处理。(已知Cr2O72-的浓度为1.0×10-3 mol /L)
方法一:电解法——向废水(酸性)中通入直流电,在阴极上,+6价的铬变为低毒的+3价。
①写出该阴极的电极反应_____________________。
方法二:某研究性学习小组为了变废为宝,在废水中加入绿矾(FeSO4·7H2O)处理得到磁性材料 CrFe2O4(Cr的化合价为+3,Fe的化合价为+3、+2)。
②欲使1 m3该废水中的Cr2O72-完全转化为CrFe2O4 ,理论上需要加入________g绿矾 。(已知FeSO4·7H2O摩尔质量为278g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组模拟“人工树叶”电化学装置如下图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极,下列说法正确的是
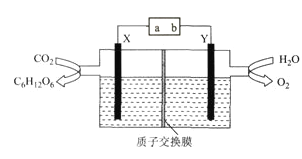
A. 电源a极为正极
B. 该装置中Y电极发生还原反应
C. X电极的电极反应式为6CO2+24H++24e-=C6H12O6+6H2O
D. 理论上,每生成22.4L(标准状况下)O2,必有4mol H+由X极区向Y极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油资源紧张曾是制约中国发展轿车事业,尤其是制约轿车进入家庭的重要因素。据报道,中国宣布将推广“车用乙醇汽油”。
(1)乙醇燃烧时如果氧气不足,可能还有CO生成.用下图装置正确验证乙醇燃烧产物有CO、![]() 、
、![]() ,应将乙醇燃烧产物依次通过,按气流从左至右顺序填装置编号______。
,应将乙醇燃烧产物依次通过,按气流从左至右顺序填装置编号______。
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(2)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是______;B瓶溶液的作用是______。
(3)装置①中所盛的是______溶液,证明燃烧产物中含有CO的实验现象是:______。
(4)装置④中所盛的固体药品是______,它可以验证的产物是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示:
CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
|
容积/L | 1 | 1 | V | |
温度/℃ | T1 | T2 | T1 | |
起始量 | 2 molC(s)、2 mol H2O(g) | 2 mol CO(g)、2 mol H2(g) | 6 molC(s)、 4mol H2O(g) |
下列说法正确的是( )
A.甲容器中,0~5min内的平均反应速率v(CO)=0.1 mol/(L·min)
B.乙容器中,若平衡时n(C)=0.56 mol,则T2>T1
C.温度为T1时,反应的平衡常数为K=9
D.丙容器的容积V=0.8 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com