
【题目】随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
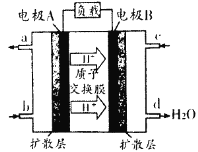
(1)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为为______,外电路中电子从______到______(填“A”或“B”)移动,写出电池负极的电极反应方程式______________
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀。
①反应中,1molCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为_________ mol。
②常温下,Cr(OH)3的溶度积Ksp=10-12(mol/L)4,当Cr3+浓度小于![]() mol
mol![]() 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
(3)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,溶液中 ________(填“增大”“减小”或“不变”);
________(填“增大”“减小”或“不变”);![]() 时,NH3H2O的电离平衡常数Kb=1.8×10-5mol/L,该温度下,1mol
时,NH3H2O的电离平衡常数Kb=1.8×10-5mol/L,该温度下,1mol![]() 的NH4Cl溶液中c(H+)=_______mol/L。(已知
的NH4Cl溶液中c(H+)=_______mol/L。(已知![]() )
)
【答案】O2 A B CH3OH—6e+H2O=CO2+6H+ 12 能 不变 2.36×10-5
【解析】
(1)由氢离子的定向移动可知A为原电池的负极,B为原电池的正极,则a通入甲醇,c通入氧气;
(2)①亚铁离子会和Cr2O72-的酸性废水反应,发生反应的离子方程式是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,结合电极方程式Fe-2e-═Fe2+计算;
②根据溶度积计算;
(3)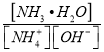 为NH3H2O电离平衡常数的倒数,温度不变,常数不变,NH4Cl溶液中存在NH4++H2ONH3H2O+H+,结合NH3H2O电离平衡常数以及Kw计算。
为NH3H2O电离平衡常数的倒数,温度不变,常数不变,NH4Cl溶液中存在NH4++H2ONH3H2O+H+,结合NH3H2O电离平衡常数以及Kw计算。
(1)电池内部阳离子向正极移动,根据题目所给示意图,H+向电解B移动,则电极B为正极,所以C处通入的物质为O2;外电路电子从负极向正极移动,所以从A到B移动;根据示意图可知电解液中含H+,负极上甲醇失去电子生成CO2和H+,所以电极方程式为:CH3OH—6e+H2O=CO2+6H+;
(2)①处理铬污染的原理是Fe做阳极发生反应:Fe—2e=Fe2+,Cr2O72氧化Fe2+,Cr2O72被还原为Cr3+,根据化合价的变化,对应关系为:Cr2O72~ 6Fe2+~6Fe,1molCr2O72-完全生成Cr(OH)3沉淀,阳极反应的Fe为6mol,外电路通过电子的物质的量为12mol;
②溶液的pH=6,则c(OH)=10-8molL1,带入溶度积公式可得:c(Cr3+)×(10-8molL1)3=10-32(molL1)4,解得c(Cr3+)=10-8molL1< 10-5molL1,能直接排放;
(3)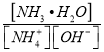 为NH4+水解平衡常数的倒数,NH4Cl溶液中加入少量NaOH,平衡常数不变,则该比值不变;根据盐类的水解与弱电解质电离的关系,水解平衡常数Kh=
为NH4+水解平衡常数的倒数,NH4Cl溶液中加入少量NaOH,平衡常数不变,则该比值不变;根据盐类的水解与弱电解质电离的关系,水解平衡常数Kh= ![]() =
=![]() =5.56×10-10molL1,则
=5.56×10-10molL1,则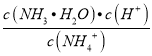 =5.56×10-10molL1,因为c(NH3H2O)≈c(H+),c(NH4+)≈1molL1,带入计算式可得c(H+)=2.36×10-5molL1。
=5.56×10-10molL1,因为c(NH3H2O)≈c(H+),c(NH4+)≈1molL1,带入计算式可得c(H+)=2.36×10-5molL1。


科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1
4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1
②N2(g)+O2(g) ![]() 2NO(g) △H2
2NO(g) △H2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下
③NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1
4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1
下列说法不正确的是
A. 反应③一定能自发进行
B. 反应②生成物总能量高于反应物总能量
C. 反应①使用催化剂,反应速率加快,△H1减小
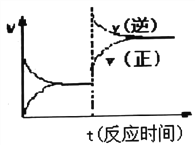
D. 反应③达到平衡后改变条件,v(正)、v(逆)的变化如图所示,则该条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸式盐NaHB在水溶液中存在下列变化:①NaHB===Na++HB-,②HB-![]() H++B2-,③HB-+H2O
H++B2-,③HB-+H2O![]() H2B+OH-,且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
H2B+OH-,且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
A. 0.01 mol·L-1的NaHB溶液,其pH可能为2
B. NaHB及H2B均为强电解质
C. 该酸式盐溶液中水电离出的氢离子浓度小于纯水中水电离出的氢离子浓度。
D. HB-的电离程度小于HB-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
(1)H2SO4:________________________________________________;
(2)Fe(OH)3:______________________________________________;
(3)NH3·H2O:____________________________________________;
(4)Na2CO3:_______________________________________________;
(5)KHCO3:_______________________________________________。
(6)Al(OH)3的酸式电离:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气的“罪魁祸首”是空气中的CO、NO、NO2等污染气体在大气中反应产生PM2.5 颗粒物,研究NO、NO2、CO 等污染物的处理,对环境保护有重要的意义。
(1)已知:
NO2(g)+CO(g) = CO2 (g)+NO(g) △H =-230.0kJ·mol-1
N2 (g)+O2 (g) = 2NO(g) △H =-180.0 kJ·mol-1
2NO(g)+O2 (g) = 2NO2 (g) △H =-112.3kJ·mol-1
若NO2气体和CO 气体反应生成无污染气体,其热化学方程式为_____。
(2) 由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
(3)汽车的排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
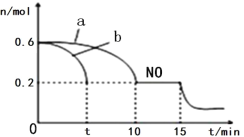
①图中a、b 分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是________(填“a”或“b”) 。
②T℃时,该反应的化学平衡常数K=____;(保留小数点后一位小数)平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_____移动。(填“向左”、“向右”或“不”)
③15min 时,若改变外界反应条件,导致n (NO)发生图中所示变化,则改变的条件可能是_________(任答一条即可)。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将x mol NH4NO3溶于水,溶液显酸性,原因是_________用离子方程式表示)。向该溶液滴加c L 氨水后溶液呈中性,则所滴加氨水的浓度为_____molL﹣1。(NH3H2O 的电离平衡常数K =2×10﹣5 molL﹣1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学研究小组用如图装置测定锌(含有少量铜)的纯度,下列操作能达到实验目的的是( )
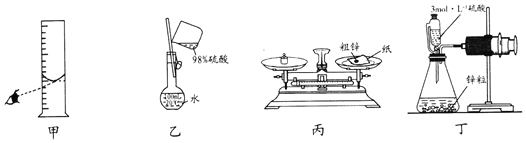
A.用装置甲量取一定体积的浓硫酸
B.用装置乙配制100mL3mo1L-1的稀硫酸
C.用装置丙称量一定质量的粗锌
D.用装置丁测量金属锌与稀硫酸反应产生氢气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.40 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是( )
A.根据实验①、②可以推测该反应正反应△H>0
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )
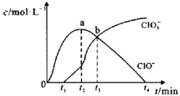
A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:c(Na+)+c(H+)=c(ClO-)+c(ClO3-)+c(OH-)
C.b点溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-=Cl-+ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO+2H2![]() CH3OH
CH3OH
Ⅱ.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
Ⅲ.CO2+H2![]() CO+H2O
CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.5 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式____________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:

①c处产生的气体是_______________;
②负极的电极反应式是_______________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
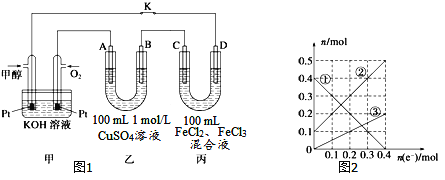
①乙中B极的电极反应式_______。
②乙中A极析出的气体在标况下的体积________。
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则②线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____mL 5mol/LNaOH溶液。
(4)蓄电池是一种反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应如下:NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
①此蓄电池在充电时,电池负极应与外加电源的________极连接。
②放电时正极的电极反应式为_____________________。
(5)按如图所示装置进行下列不同的操作
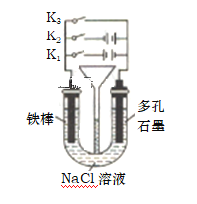
①将K1 、K2、 K3分别只关闭一个,则铁的腐蚀的速度最快的是只闭合_____(填“K1”或 “K2”或“K3”,下同),为减缓铁的腐蚀, 只闭合_____,该防护法称为______________。
②只闭合K3,当铁棒质量减少5.6g时,石墨电极消耗的气体体积为__________L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com