
| A. | 已知:HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol,则氢气的燃烧热为△H=-285.8 kJ/mol | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)=2H2O2(l)△H=+108.3kJ/mol ①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol ②则有反应:N2H4(l)+2 H2O2(l)=N2(g)+4H2O(l)△H=-642.3kJ/mol | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol |
分析 A.1mol HI发生可逆反应,不能完全分解;
B.1molH2完全燃烧生成稳定氧化物水(液态)放出的热量为燃烧热,物质的量与热量成正比;
C.由盖斯定律可知,②-①得到N2H4(l)+2 H2O2(l)=N2(g)+4H2O(g);
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,可知1molNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ×2=57.4kJ的热量,而醋酸电离吸热.
解答 解:A.1mol HI发生可逆反应,不能完全分解,则由热化学方程式可知1mol HI气体在密闭容器中充分分解后可以放出热量小于26.5kJ,故A错误;
B.1molH2完全燃烧生成稳定氧化物水(液态)放出的热量为燃烧热,物质的量与热量成正比,则氢气的燃烧热为△H=-285.8 kJ/mol,故B正确;
C.由盖斯定律可知,②-①得到N2H4(l)+2 H2O2(l)=N2(g)+4H2O(g)△H=-642.3kJ/mol,若生成液态水放热的热量更多,故C错误;
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,可知1molNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ×2=57.4kJ的热量,而醋酸电离吸热,则NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H>-57.4 kJ/mol,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中的能量变化、燃烧热和中和热的判断为解答的关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
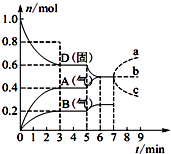 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列叙述不正确的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列叙述不正确的是( )| A. | 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.066 7 mol/(L•min) | |
| B. | 该反应的化学方程式为2D(s)?2A(g)+B(g),该反应的平衡常数表达式为K=c2(A)•c(B) | |
| C. | 已知反应的△H>0,则第5 min时图象呈现上述变化的原因可能是升高体系的温度 | |
| D. | 若在第7 min时增加D的物质的量,则表示A的物质的量变化正确的是a曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 已知 编号 | 起始状态物质的量/mol | 平衡时NH3的 物质的量/mol | ||
| N2 | H2 | NH3 | ||
| 1 | 4 | 0 | a | |
| ① | 1.5 | 9 | 0 | >1.5a |
| ② | 0 | 0.5 | 1 | 0.5a |
| ③ | m | g(g≥4m) | 0 | am或者$\frac{ag}{4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁可用来制造红色油漆和涂料 | |
| B. | 生铁、普通钢和不锈钢中的含碳量依次减小 | |
| C. | 硅胶可用作实验室和袋装食品、瓶装药品等的干燥剂 | |
| D. | 硅是生产光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物和还原产物的物质的量之比为2:1 | |
| B. | 转移4 mol电子时,只需向装置中通人44.8 L H2(标准状况) | |
| C. | 装药品之前加热装置至100℃并持续一会儿 | |
| D. | 制备硼氢化钠的副产物可能有NaH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com