
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合液的pH |
| ① | 0.2 | 0.1 | pH>7 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.1 | pH=9 |
| A. | 由实验①可知,HA为弱酸 | |
| B. | 实验①所得混合溶液:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 实验②所得混合溶液:c(Na+)=c(A-) | |
| D. | 实验③所得混合溶液中由水电离出的OH-的浓度为1×10-9mol•L-1 |
分析 A、将某0.2mol/L的一元酸HA和0.1mol/L的NaOH溶液等体积混合,则酸会剩余,得到等浓度的酸和盐;
B、将某0.2mol/L的一元酸HA和0.1mol/L的NaOH溶液等体积混合,得到等浓度的酸和盐,溶液显示碱性,说明溶液中离子的水解程度较大,据此回答;
C、根据强酸强碱混合以及强碱弱酸混合后溶液的组成特点集合电荷守恒来判断;
D、将某0.1mol/L的一元酸HA和0.1mol/L的NaOH溶液等体积混合,得到的是NaA的盐溶液,显示碱性,说明弱离子存在水解,据Kw等于氢离子和氢氧根离子浓度乘积来回答.
解答 解:A、将某0.2mol/L的一元酸HA和0.1mol/L的NaOH溶液等体积混合,则酸会剩余,得到等浓度的酸和盐,结果pH>7,说明溶液中A-离子的水解程度较大于HA的电离程度,所以HA为弱酸,故A正确;
B、将某0.2mol/L的一元酸HA和0.1mol/L的NaOH溶液等体积混合,得到等浓度的酸和盐,溶液显示碱性,说明溶液中离子的水解程度较大,此时存在:c(Na+)>c(A-)>c(OH-)>c(H+),故B正确;
C、根据混合后溶液pH=7,得到c(OH-)=c(H+),根据电荷守恒c(OH-)+c(A-)=c(H+)+c(Na+),得到:c(Na+)=c(A-),故C正确;
D、将某0.1mol/L的一元酸HA和0.1mol/L的NaOH溶液等体积混合,得到的是NaA的盐溶液,显示碱性,说明弱离子存在水解,溶液中由水电离出的OH-的浓度为1×10-5mol•L-1,故D错误.
故选D.
点评 本题考查酸碱混合的判断,题目难度中等,本题注意分析表中数据,从弱电解质的电离和盐类水解的角度解答,学习中注重相关规律和方法的积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
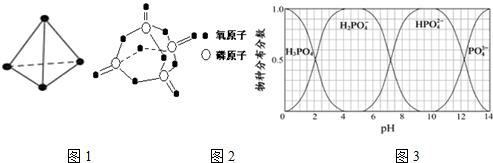
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然蛋白质水解的最终产物均为氨基酸 | |
| B. | 油脂水解得到的醇是丙三醇 | |
| C. | 淀粉、纤维素、蛋白质和油脂都属于高分子化合物 | |
| D. | 淀粉、纤维素水解的产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,该溶液中一定含有CO32- | |
| B. | 某溶液加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 某溶液中加入AgNO3溶液有白色沉淀生成,一定有Cl-存在 | |
| D. | 某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 营养平衡、合理用药是保证人体健康和生活质量的重要途径.
营养平衡、合理用药是保证人体健康和生活质量的重要途径.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
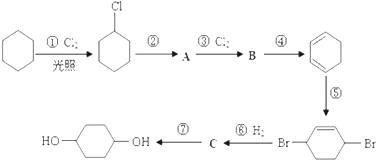
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加酚酞显无色的溶液 | B. | 与Al 反应放出H2 的溶液 | ||
| C. | pH<7 的溶液 | D. | c(H+)>c(OH-)的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com