
分析 (1)根据除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质,调整溶液的pH时,加入的物质不能引进新的杂质粒子.以此来解答;
(2)依据氢氧化铜饱和溶液中溶度积常数计算溶液中的氢离子浓度计算PH;结合氢氧化铁溶度积和残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全.
解答 解:(1)除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质,四个选项中,只有双氧水氧化后生成水,双氧水受热见光易分解,没有多余杂质;调整溶液的pH时,加入的物质不能引进新的杂质粒子,氢氧化钠中含有钠离子,氨水反应后生成铵根离子,所以氢氧化钠和氨水能引进新的杂质离子,CuO粉末、Cu(OH)2悬浊液反应后生成铜离子和水而不引进新的杂质离子,故选CD.
故答案为:B;CD;
(2)Cu(OH)2的溶度积Ksp=3.0×10-20,溶液中CuSO4的浓度为3.0mol•L-1,c(Cu2+)=3.0mol•L-1;依据溶度积常数c(Cu2+)×c2(OH-)=3.0×10-20 ;c2(OH-)=$\frac{3×1{0}^{-20}}{3.0}$=10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OH-)=10-14;求的c(H+)=10-4mol/L,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=$\frac{8.0×1{0}^{-38}}{1×1{0}^{-5}}$=8.0×10-33;c(OH-)=2×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol/L,则pH=3.3;通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行.
故答案为:4;3.3;可行.
点评 本题考查了沉淀转化的原理应用,除杂的原理应用,主要是溶解沉淀的转化关系的分析应用和计算,题目难度中等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 排水法收集气体后,先熄灭酒精灯,再取出导气管 | |
| B. | 蒸馏自来水时,冷凝水从上口进,从下口出 | |
| C. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| D. | 稀释浓硫酸时,应将浓硫酸慢慢加入水中并及时搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28g氮气的体积约为22.4升 | |
| B. | 标准状况下,11.2L水含有1mol氢原子 | |
| C. | 标准状况下,11.2L氧气与硫充分反应,转移的电子数目为2NA | |
| D. | 常温常压下,1mol氯气完全被碱吸收需要NA个氢氧根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中:Na+、K+、SiO32-、CO32- | |
| B. | pH=13的溶液:Ba2+、Na+、I-、ClO- | |
| C. | 苯酚钠溶液中:HSO3-、K+、Na+、AlO2- | |
| D. | 加入淀粉碘化钾溶液显蓝色:Na+、NH4+、SO42-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L H2O中所含的原子总数为0.3NA | |
| B. | 0.1 molCl2与足量的NaOH稀溶液反应,转移的电子总数为0.2NA | |
| C. | 1mol•L一1的NaCl溶液中所含Na+数目为NA | |
| D. | 常温常压下,14g由N2和CO组成的混合气体中含有的原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知甲、乙、丙是初中化学常见的三种物质,它们的组成元素中只有一种相同,其中乙物质能参与绿色植物的光合作用.转化关系如图所示,试判断:
已知甲、乙、丙是初中化学常见的三种物质,它们的组成元素中只有一种相同,其中乙物质能参与绿色植物的光合作用.转化关系如图所示,试判断:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  | 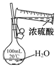 | 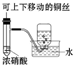 |
| A.制备少量氨气 | B.吸收HCl | C.配制一定浓度硫酸溶液 | D.制备并收集少量NO2气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO2)=0.1mol/L | B. | c(O2)=0.05mol/L | C. | c(SO3)=0.5mol/L | D. | c(SO2)=0.4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com