

分析 孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2,向孔雀石中加入足量稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑、FeO+H2SO4=FeSO4+H2O,SiO2和稀硫酸不反应,过滤得到固体SiO2,溶液A中含有含有亚铁盐及硫酸铜,气体E为CO2,向溶液A中加入试剂①得到溶液B,试剂①是一种氧化剂,将Fe2+转化为Fe3+且不能引进杂质,可选取双氧水,向溶液B中加入CuO调节PH值使三价铁离子沉淀,过滤得到D为Fe(OH)3,溶液C为硫酸铜溶液,经蒸发浓缩(或加热蒸发、蒸发溶液),冷却结晶、过滤,得到产品.
(1)碱式碳酸铜为碱式盐能与稀硫酸反应,依据影响化学反应速率的因素分析判断;
(2)双氧水是一种绿色氧化剂,将Fe2+氧化为Fe3+;
(3)在溶液B中加CuO调节溶液的pH使Fe3+完全沉淀,且不引入新的杂质;
(4)依据溶度积常数计算氢氧根离子浓度,结合离子积常数计算氢离子浓度得到溶液PH;
(5)溶液中得到溶质的方法是经蒸发浓缩(或加热蒸发、蒸发溶液),冷却结晶、过滤,得到产品;
(6)Fe2+溶液与KMnO4溶液发生氧化还原反应,反应中MnO4-被还原为Mn2+,最小公倍数为5,所以KMnO4前系数为1,Fe2+前系数为5,结合原子守恒和电荷守恒配平写出离子方程式,结合定量关系计算亚铁离子浓度.
解答 解:孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2,向孔雀石中加入足量稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑、FeO+H2SO4=FeSO4+H2O,SiO2和稀硫酸不反应,过滤得到固体SiO2,溶液A中含有含有亚铁盐及硫酸铜,气体E为CO2,向溶液A中加入试剂①得到溶液B,试剂①是一种氧化剂,将Fe2+转化为Fe3+且不能引进杂质,可选取双氧水,向溶液B中加入CuO调节PH值使三价铁离子沉淀,过滤得到D为Fe(OH)3,溶液C为硫酸铜溶液,经蒸发浓缩(或加热蒸发、蒸发溶液),冷却结晶、过滤,得到产品.
(1)碱式碳酸铜为碱式盐能与稀硫酸反应:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,生成硫酸铜、水和二氧化碳,为了提高原料浸出速率,可采取的措施有增加硫酸浓度、将原料粉碎、提高反应温度,加催化剂等,
故答案为:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;增加硫酸浓度;提高反应温度;
(2)Fe2+具有还原性,双氧水是一种绿色氧化剂,将Fe2+氧化为Fe3+,不产生污染物,也不引入杂质,只有c正确,
故答案为:c;
(3)在溶液B中加CuO调节溶液的pH使Fe3+完全沉淀,且不引入新的杂质,
故答案为:调pH值,(或减少c(H+),)使Fe3+沉淀完全;
(4)常温下Fe(OH)3的Ksp=1×10-39,使溶液中c(Fe3+)=1×10-3mol/L,则c(OH-)=$\root{3}{\frac{1×1{0}^{-39}}{1×1{0}^{-3}}}$mol/L=1×10-12mol/L,所以溶液中c(H+)=1×10-2mol/L,则pH=2,
故答案为:2;
(5)CuSO4•5H2O晶体,在高温时易失去水,所以从溶液中获得CuSO4•5H2O晶体,需要经蒸发浓缩(或加热蒸发、蒸发溶液),冷却结晶、过滤,
故答案为:蒸发浓缩(或加热蒸发、蒸发溶液);冷却结晶;
(6)Fe2+溶液与KMnO4溶液发生氧化还原反应,反应中MnO4-被还原为Mn2+,最小公倍数为5,所以KMnO4前系数为1,Fe2+前系数为5,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,根据离子方程可知MnO4-~5Fe2+,用去KMnO4的物质的量为10.00×10-3L×0.010mol/L=1.0×10-4mol,所以A溶液中Fe2+浓度为$\frac{1.0×1{0}^{-4}mol×5}{0.02L}$=0.025mol/L,
故答案为:0.025.
点评 本题考查以孔雀石为主要原料制备CuSO4•5H2O,为高频考点和常见题型,侧重于学生的分析、实验和计算能力得到考查,注意把握实验的原理以及物质的性质,为解答该类题目的关键,注意掌握实验基本操作和流程分析,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应中,反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟化氢的电子式: | B. | 中子数为21的钾原子:${\;}_{19}^{40}$K | ||
| C. | NH3的结构式: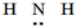 | D. | N3-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液 | |
| B. | c(OH-)=1.0×10-13mol•L-1的溶液 | |
| C. | 0.6%的醋酸(ρ=1g•cm-3) | |
| D. | pH=2的盐酸与pH=12的氢氧化钡溶液等体积混合后所得溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
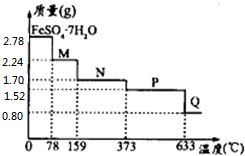
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.
①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.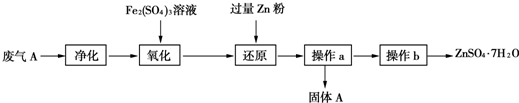
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com