
【题目】按要求回答下列问题:
Ⅰ.(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为________________________。
(2)已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
Ⅱ.已知水的电离平衡曲线如图所示,试回答下列问题:
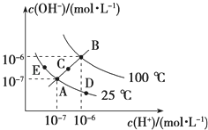
(3)图中五点KW间的关系是__________________.
(4)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(5)E对应的温度下,在pH=9的NaOH溶液与pH=4的H2SO4 溶液中,水电离出的H+浓度之比为:________,若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
【答案】H2(g) + I2(g) ![]() 2HI(g) △H=-14.9kJ/mol > a-2b-2c B>C>A=D=E c 10:1 10:1
2HI(g) △H=-14.9kJ/mol > a-2b-2c B>C>A=D=E c 10:1 10:1
【解析】
(1)利用0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,来计算放出的热量,根据反应热书写热化学方程式;
(2)化学反应气体体积增加,则熵增大;根据盖斯定律计算反应热;
(3)KW只与温度有关,温度升高KW变大;
(4)由图可知,A点和D点温度相同,A点为中性,D点为酸性,以此分析;
(5)E对应的温度下为常温,KW=1![]() 10-14,酸和碱都抑制水的电离,NaOH溶液中由水电离出的H+等于溶液中的H+,H2SO4 溶液中由水电离出的H+浓度等于溶液中的OH-,若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液恰好完全反应,据此分析。
10-14,酸和碱都抑制水的电离,NaOH溶液中由水电离出的H+等于溶液中的H+,H2SO4 溶液中由水电离出的H+浓度等于溶液中的OH-,若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液恰好完全反应,据此分析。
(1)0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,则1molH2(g)与足量I2(g)完全反应放出14.9kJ的热量,热化学方程式为:H2(g) + I2(g) ![]() 2HI(g) △H=-14.9kJ/mol,
2HI(g) △H=-14.9kJ/mol,
因此,本题正确答案为:H2(g) + I2(g) ![]() 2HI(g) △H=-14.9kJ/mol;
2HI(g) △H=-14.9kJ/mol;
(2)反应①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g)是气体分子数增加的反应,故ΔS>0;
已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
②![]() 2+③
2+③![]() 2—①得2C(s)+4H2(g)+O2(g) = 2CH3OH(l) 的ΔH=(a-2b-2c)kJ/mol。
2—①得2C(s)+4H2(g)+O2(g) = 2CH3OH(l) 的ΔH=(a-2b-2c)kJ/mol。
因此,本题正确答案为:a-2b-2c;
(3)KW只与温度有关,且温度升高KW变大,由图可知,温度B>C>A=D=E,所以KW间的关系是B>C>A=D=E;
因此,本题正确答案为:B>C>A=D=E;
(4)由图可知,A点和D点温度相同,A点为中性,D点为酸性,
a.升温会使温度升高,不符合题意,故不选a;
b.加入少量的NaOH碱性增强,不符合题意,故不选b;
c.加入少量的NH4Cl,由于NH4+水解使溶液显酸性,c(H+)>c(OH-),故c符合题意,选c。
因此,本题正确答案为:c;
(5)E对应的温度下为常温,KW=1![]() 10-14,酸和碱都抑制水的电离,NaOH溶液中由水电离出的H+等于溶液中的H+,H2SO4 溶液中由水电离出的H+浓度等于溶液中的OH-,则在pH=9的NaOH溶液与pH=4的H2SO4 溶液中,水电离出的H+浓度之比为:
10-14,酸和碱都抑制水的电离,NaOH溶液中由水电离出的H+等于溶液中的H+,H2SO4 溶液中由水电离出的H+浓度等于溶液中的OH-,则在pH=9的NaOH溶液与pH=4的H2SO4 溶液中,水电离出的H+浓度之比为:![]() =10:1;
=10:1;
若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液恰好完全反应,设NaOH溶液与H2SO4溶液的体积分别为V1、V2,则![]()
因此,本题正确答案为:c ;10:1 ;10:1。


科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的容器中发生反应X(g)+3Y(g) ![]() aZ(g) △H<0,各组分浓度如下表
aZ(g) △H<0,各组分浓度如下表
物质 | X | Y | Z |
初始浓度/ mol·L-1 | 0.1 | 0.3 | 0 |
2min末浓度/mol·L-1 | 0.08 | 0.04 | |
平衡浓度/mol·L-1 | 0.1 |
(1)0~2min的平均速率ν(Y) =___________________
(2)达平衡时X的转化率为___________________
(3)a =_______________
(4)平衡时Y的浓度为________________
(5)下列能表示该反应一定达到平衡状态的______________
①单位时间内生成n mol X的同时生成n mol Z
②c(X):c(Y):c(Z)的比值不再变化
③容器中的气体的质量不再变化
④容器中混合气体的平均相对分子质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上。
①金刚石与“足球烯”、C60;②氧气(O2)与臭氧(O3);③16O、17O和18O;④CH4和CH3CH2CH3;
⑤乙烯和乙烷;⑥![]() 和
和![]() ;⑦
;⑦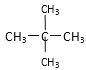 和
和![]() ;
;
(1)同位素___,
(2)同系物___,
(3)同分异构体___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应:2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:


①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________(“增大”或“减小”)。
(2)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的ΔH______0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为__________________;平衡时混合气体中NO2的体积分数为_______。
②100℃时达平衡后,向容器中迅速充入含0.08mol的NO2和0.08mol N2O4 的混合气体,此时速率关系v(正)____v(逆)。(填“大于”,“等于”,或“小于”)
③100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a.T________100℃(填“大于”或“小于”),判断理由是____________________
b.列式计算温度T时反应的平衡常数K2(写计算过程):______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将W1g光亮的铜丝在空气中加热一段时间后,迅速伸入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2g。实验时由于所伸入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是( )
A.NaOH溶液,W1=W2B.NaHSO4溶液,W1<W2
C.无水乙醇,W1=W2D.CO,W1>W2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应X(g)+2Y(g) ![]() 2Z(g)。下列叙述能判断该反应达到化学平衡的是
2Z(g)。下列叙述能判断该反应达到化学平衡的是
① X、Y、Z的物质的量之比是1∶2∶2 ② X、Y、Z的浓度不再发生变化③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时消耗n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从本质入手看物质及其能量的变化,可以让我们更加深入的去理解所学知识的内涵及外延应用。对于《原电池》这部分知识也是如此,如图是原电池的基本构造模型:

(1)若a和b的电极材料为Al或Mg。
①若c为稀NaOH溶液时,则a的电极材料为__,该极电极方程式为___。
②若c为稀H2SO4时,则a的电极材料为___,该极电极方程式为__。
(2)对于原电池的应用,以下说法正确的是__。
A.选择构成原电池两极材料时,必须选择活泼性不同的两种金属材料
B.构成原电池时,负极材料的活泼性一定比正极材料的强
C.构成原电池时,作为负极材料的金属受到保护
D.从能量转化角度去看,如图的氧化还原反应能量变化曲线,则不能够设计原电池

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝在工业生产中有多种用途。请根据信息回答:
(1)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN)
己知:2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351 kJ·mol-1
2C(s)+O2 (g)=2CO(g); △H2=-221 kJ·mol-1
2Al(g)+N2(g)=2AlN(s) △H3=-318 kJ·mol-1
则碳热还原法合成AlN的热化学方程式为_____。
(2)电解氧化铝生产铝时,阳极产生的副产物CO2,可通过CO2甲烷化再利用,反应原理为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H4。
CH4(g)+2H2O(g) △H4。
常压下以Ru/TiO2作催化剂,在恒容且容积相同的不同容器中,分别充入10mol CO2和H2的混合气体(体积比1:4)于不同温度下进行反应,第tmin时分别测定CH4的体积分数![]() ,并绘成如图甲所示曲线。
,并绘成如图甲所示曲线。
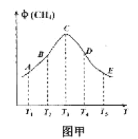
①A、B、C、D、E五点中,尚未达到平衡的点是___,该反应的△H4__0(填“>”或“<”)。
②350℃时,在2L恒容密闭容器中测得CO2的平衡转化率如图乙所示,则前10 min的平均反应速率v(CO2)=___;平衡常数为____
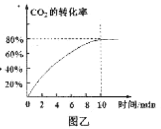
(3)据文献报道,科学家利用氮化镓材料与铜组成如图所示的人工光合系统装置,成功地以CO2和H2O为原料合成了CH4。
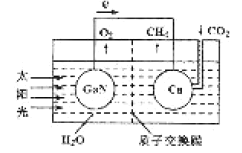
①写山铜电极表面的电极反应式____。
②为提高该人工光合系统的工作效率,可向装置中加入少量__(选填“盐酸”或“硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)图中表示NO2的变化的曲线是___(填字母);
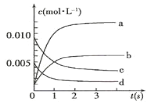
(2)800℃,反应达到平衡时,NO的转化率是___ ;
(3)用O2表示从0~2s内该反应的平均速率v=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com