
某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
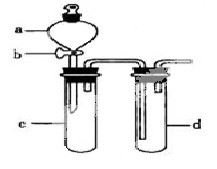
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是__________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________。
再由a向c中加2mL蒸馏水,c中的实验现象是_____________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____,理由是_______。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是_________;该小组同学实验目的是_________,但此实验的不足之处是_____________________。
(1)检查装置气密性
(2)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;反应变缓,气体颜色变淡
(3)丙;耗酸量最少,无污染
(4)c中有黄绿色气体产生,d中溶液变为黄棕色;证明氧化性KMnO4>Cl2>Br2;没有处理尾气
【解析】(1)因实验前要检查装置气密性,这是检查装置气密性的常见方法。
(2)因铜与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,由a向c中加2mL蒸馏水,硝酸进行稀释,反应变慢,因为二氧化氮能和水反应,c??的气体颜色变浅。
(3)铜与浓硝酸反应会产生污染环境的NO2气体,且硝酸的利率率为其物质的量的1/2;铜与稀硝酸反应会产生对环境污染的NO,其利率率为为其物质的量的3/4;故丙中铜与氧气反生成CuO,再与稀硝酸反应,对环境不污染,且耗硝酸要少。
(4)高锰酸钾溶液与浓盐酸反应生成Cl2,说明氧化性KMnO4强于Cl2;利用产生的Cl2与KBr反应得到Br2,则说明Cl2的氧化性强于Br2。故,c中有黄绿色气体产生,d中溶液变为黄棕色,同时要注意尾气吸收。


科目:高中化学 来源:2014高考名师推荐化学微粒的组成、结构及性质(解析版) 题型:选择题
元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是
①原子序数:A>B
②离子半径:aAm+<bBn-
③原子半径:A<B
④元素所在的周期数:A>B
⑤A的最高正价与B的最低负价的绝对值相等
⑥b=a+m-n
A.②③④ B.①②④ C.④⑤⑥ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:实验题
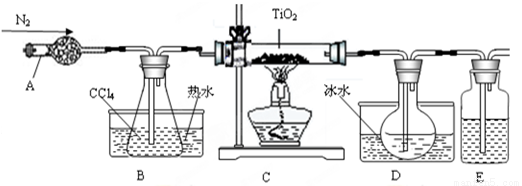
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:
有关性质如下表
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解TiOSO4(aq)+ 2H2O(l)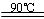 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验药品保存、基本操作、检验(解析版) 题型:选择题
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是

A.1将海带灼烧成灰
B.2过滤得含I-溶液
C.3放出碘的苯溶液
D.4分离碘并回收苯
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:填空题
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:
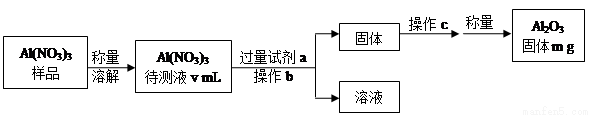
①加入试剂a后发生反应的离子方程式为 。
②操作b为 ,操作c为 。
③Al(NO3)3待测液中,c (Al3+) = mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
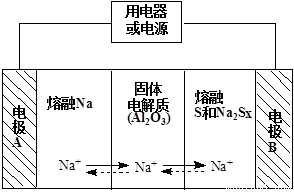
①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
a.100℃以下 b.100℃~300℃ c.300℃~350℃ d.350℃~2050℃
②放电时,电极A为 极。
③放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx=2Na + xS(3<x<5),则阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:实验题
实验室用少量的溴水和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |

回答下列问题:
(1)烧瓶D中发生的主要的反应方程式 。
(2)安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞。请写出发生堵塞时瓶B中的现象 。
(3)在装置C中应加入 (填字母) ,其目的是_______________。
a.水 b.浓硫酸 c.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用 洗涤除去。(填字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
采取分离的主要玻璃仪器是 ;
(5)若产物中有少量副产物乙醚,可用 的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 。
(7)判断该制各反应已经结束的最简单方法是 ;
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学守恒及离子浓度大小的比较(解析版) 题型:选择题
向10 mL 0.1 mol·L-1Na2CO3溶液中逐滴滴加V mL 0.1 mol·L-1HCl溶液,下列有关滴定过程中粒子浓度关系正确的是
A.当V=0时,c(OH-)=c(H+)+c( )+c(H2CO3)
)+c(H2CO3)
B.当V=5时,c(Na+)+c(H+)=2c(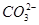 )+c(
)+c( )+c(OH-)
)+c(OH-)
C.当V=10时,c(Cl-)=c(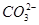 )+c(
)+c( )+c(H2CO3)
)+c(H2CO3)
D.当V=15时,c(Na+)=c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学周期表、核素(解析版) 题型:选择题
重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子
B.1H与D互称同位素
C.H2O与D2O互称同素异形体
D.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学键与分之间作用力(解析版) 题型:选择题
下列叙述正确的是
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失去电子的原子,易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
A.①⑦ B.①⑤⑦ C.⑦ D.②⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com