
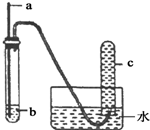
 用下图所示装置进行实验,实验现象对应的结论正确的是( )
用下图所示装置进行实验,实验现象对应的结论正确的是( )| a | b | 实验现象 | 结论 | |
| A | 铜丝 | 稀硝酸 | c中收集到大量无色气体 | 稀硝酸与铜反应生成NO2 |
| B | 木条 | 18.4mol/L浓硫酸 | 木条变黑 | 浓硫酸具有酸性 |
| C | 铁钉 | 饱和食盐水 | 部分水进入导管 | 铁钉发生吸氧腐蚀 |
| D | 铝片 | 浓硝酸 | 无明显现象 | 铝与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化氮能与水反应生成一氧化氮;
B.木条变黑,说明浓硫酸具有脱水性;
C.食盐能够加快铁钉的锈蚀,因此铁生锈会消耗氧气;
D.钝化现象是浓硝酸强氧化性的表现.
解答 解:A.铜和稀硝酸反应生成一氧化氮,一氧化氮能与装置中的空气反应生成二氧化氮,二氧化氮能与水反应生成一氧化氮,故A错误;
B.将木条伸进18.4mol/L的浓硫酸,木条变黑,说明浓硫酸具有脱水性而不是酸性,故B错误;
C.食盐能够加快铁钉的锈蚀,因此铁生锈会消耗氧气,使试管内的气压变小,因此大气压会把水压入导管,故C正确;
D.常温下浓硝酸与铝发生钝化反应,在表面形成氧化物薄膜阻止反应进行,铝与浓硝酸反应,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的制备与性质,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.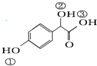 )中①、②、③3个-OH的酸性由强到弱的顺序是:③>①>②.
)中①、②、③3个-OH的酸性由强到弱的顺序是:③>①>②. 任意2种.
任意2种.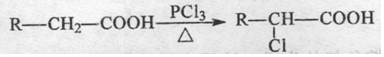 A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选).合成路线流程图示例如下:
A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 喝不含杂质的纯净水比喝矿泉水对人体更营养、更健康 | |
| B. | 维生素C具有较强还原性,熟吃新鲜蔬菜维生素C损失小 | |
| C. | 波尔多液是由硫酸铜溶液、生石灰和水制得,可用于防治植物的病虫害 | |
| D. | 亚硝酸钠具有强还原性而使肉类长时间保持鲜红,可在肉制食品中宜多加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
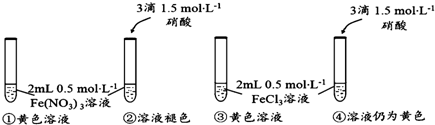

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
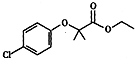
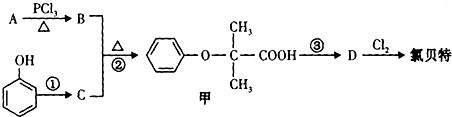
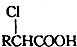

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+ | |
| B. | 硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- | |
| C. | 氯水具有漂白性:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
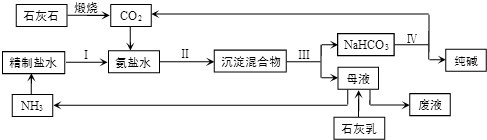
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的化学式相同,两者互为同分异构体 | |
| B. | 苯能和氢气发生加成反应,是由于其结构中有碳碳双键 | |
| C. | 紫外线杀菌是在紫外线条件下,蛋白质发生盐析杀死细菌 | |
| D. | 乙醇和乙酸都能与金属钠反应放出氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com