
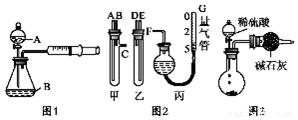
分析 (1)使装置内外形成气压差是气密性检查的常用手段;
(2)①由图装置可知甲有c支管,应为生产气体装置,则甲应放入Na2CO3、NaCl的固体混合物,乙放入硫酸;
②图中量气装置和碱式滴定管相似;
③连接导管时,应用A连接D,B连接E,C连接F;
④读数时应使丙装置内外气压相等,故读数前应使左右两边液面相平;
(3)根据碱石灰的成分可知,碱石灰既可吸收二氧化碳也可吸收水,以及干燥管与空气接触等进行分析即可.
解答 解:(1)使装置内外形成气压差是气密性检查的常用手段,检查该装置的气密性可关闭A处分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好,
故答案为:关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气;
(2)①由图装置可知甲有c支管,应为生产气体装置,则甲应放入Na2CO3、NaCl的固体混合物,乙放入硫酸,
故答案为:甲;乙;
②G为量气装置,根据构造,可用碱式滴定管代替,
故答案为:碱式滴定管;
③连接导管时,应用A连接D,B连接E,C连接F,
故答案为:D E F;
④读数时应装置内外气压相等,读数前应上下移动滴定管,使左右两边液面相平,
故答案为:上下移动滴定管,使左右两边液面相平;
(3)因生产的CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中,会导致质量偏大,
故答案为:CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中.
点评 本题考查物质的含量测定的实验设计,侧重于考查学生分析能力和实验能力,题目较为综合,为高考常见题型,注意把握实验原理和操作方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2和D2互为同素异形体 | B. |  和 和  互为同分异构体 互为同分异构体 | ||
| C. |  和 和  是同一种物质 是同一种物质 | D. | 乙醇的同分异构体是HO-CH2CH2-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | X 为该电池的正极 | |
| B. | 若两电极分别为铜和锌,则X为铜,Y为锌 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则X的还原性强于Y |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 离子(0.1mol/L) | Cu2+ | Fe2+ | Fe3+ | 提供的药品(根据需要选择使用) |
| 氢氧化物开始沉淀pH | 4.7 | 7.0 | 1.9 | Cl2、NaOH溶液、CuO、Cu |
| 氢氧化物沉淀完全pH | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和  | |
| B. |  和 和  | |
| C. | 甲苯和二甲苯 | |
| D. | CH2=CH-CH=CH2和CH3-CH2-CH2-C≡CH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com