氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)用CH
4催化还原NO
x可以消除氮氧化物的污染.例如:
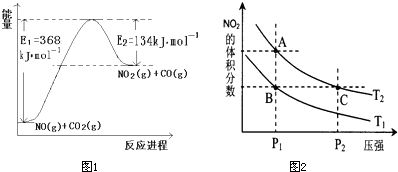
CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g)△H
1=-574kJ?mol
-1CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g)△H
2若1mol CH
4还原NO
2至N
2,整个过程中放出的热量为867kJ,则△H
2=______;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H
+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N
2+3H
2 
2NH
3,则在电化学合成氨的过程中,阴极反应式为______;
(3)在一定条件下,将l mol N
2与3mol H
2混合于一个10L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,
试回答:①N
2的转化率为______;
②右图中在状态A时,平衡常数 K
A______(填写代入数值的表达式,不要求算出具体数值);当温度由T
1变化到T
2时,K
A______ K
B(填“>”、“<”或“=”).
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
时间/min
浓度/mol.L | c (N2) | c (H2) | c (NH3) |
| 0.6 | 1.8 | |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
反应从0min到3min之间,H
2的反应速率为______;反应在3min时,条件发生了改变,改变的条件可能是______ (填序号).
a.使用催化剂 b.降低温度 c.增加H
2的浓度.

 2NH3,则在电化学合成氨的过程中,阴极反应式为______;
2NH3,则在电化学合成氨的过程中,阴极反应式为______;
 2NH3,利用平衡三部曲和氨的体积分数求出各物质的物质的量,根据转化率的定义求解;
2NH3,利用平衡三部曲和氨的体积分数求出各物质的物质的量,根据转化率的定义求解; 2NH3
2NH3 ×100%=25%,解得:a=0.4,
×100%=25%,解得:a=0.4, ×100%=40%,故N2的转化率为40%;
×100%=40%,故N2的转化率为40%; =
= ,故答案为:
,故答案为: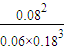 ;升高温度平衡向吸热的方向移动,即逆反应方向移动,平衡常数减小,故答案为:>;
;升高温度平衡向吸热的方向移动,即逆反应方向移动,平衡常数减小,故答案为:>; =
= mol?L-1?min-1,而V(H2)=3V(N2)=0.08 mol?L-1?min-1,
mol?L-1?min-1,而V(H2)=3V(N2)=0.08 mol?L-1?min-1,

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案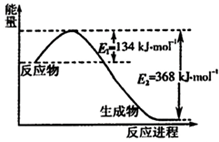 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.