
����Ŀ����ѧ�����������ߣ��������ǵ��ճ�����������أ���Ҫ��ش��������⣺
��1��ȱ����ƶѪ����Ӧ����Fe2����ͨ����������������ʽ���䣬��������������ҩЧ���������������Ƴ�ҩƬʱ�������һ����������£�������µ�������_________________.
��2�������γ���д����������ʽ���س�ʯ��K2Al2Si6O16��д�����������ʽΪ____________.
��3��Ư�۾�����Ч�ɷֵĻ�ѧʽΪ_________________.
��4����������������ǽ������ϵ����ǣ����й㷺Ӧ�õĹ��ά�ɷ���_____________________
��5���մɡ�ˮ��Ͳ����dz��õĴ�ͳ�����ǽ������ϣ�����������ͨ��������Ҫԭ����_________������������Һ�����ò�������ԭ���ǣ���ѧ����ʽ��_________________.
��6������ǵ�ˮ�м�������KAl(SO4)212H2O��ˮ�ɵõ�������д��������ˮ�еĵ��뷽��ʽ_______����������Һ����μ���Ba(OH)2��Һֱ��Al3+ǡ�ó�����ȫ��������Ӧ�����ӷ���ʽΪ_________________ .
��7������ˮ�е�NO3-�����ཡ������Σ����Ϊ�˽�������ˮ��NO3-��Ũ�ȣ������ڼ��������������۽�NO3-��ԭΪN2���仯ѧ����ʽΪ��10Al+6NaNO3+4NaOH�T10NaAlO2+3N2��+2H2O��
��ش��������⣺
���ڻ�ѧ����ʽ���õ����ű���÷�Ӧ�е���ת�Ƶķ������Ŀ��_________________.
��������Ӧ�������ɱ����3.36L N2����ת�Ƶĵ�����ĿΪ��_________________.
���𰸡���ֹ�������������� K2O��Al2O3��6SiO2 Ca(ClO)2 SiO2 ���ʯӢ��ʯ��ʯ SiO2+2NaOH=Na2SiO3+H2O KAl(SO4)2=K++Al3++2SO42- 2Al3++3Ba2++6OH-+3SO42-=2Al(OH)3��+3BaSO4�� 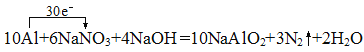 1.5NA
1.5NA
��������
��1������FeSO4���ȶ����ڿ������ױ��������������з�������2����������д����������ʽ�Ĺ��ɼ����ý���������д��ǰ�ߣ��Դ�������ɣ���3������Ư�۵���ȡԭ�����н�𣻣�4������������ˮ��������������������Ծ�ˮ��ԭ��������𣻣�5������������ԭ��Ӧ��ʧ�����غ���н��
��1��FeSO4�ױ����������ʣ����¿�����FeSO4���������е����������������������һ����������£��ʴ�Ϊ:����FeSO4���������е�����������
��2�������γ���д����������ʽ���س�ʯ��K2Al2Si6O16��д�����������ʽ˳��Ϊ�����ý���������д��ǰ�ߣ��Դ����Ƽ�����д��K2O��Al2O3��6SiO2 ���𰸣�K2O��Al2O3��6SiO2��
��3��������Ca(OH)2��Ӧ����CaCl2��Ca(ClO)2��ˮ����Ӧ�ķ���ʽΪ2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O�������Ȼ��ƺʹ�����ƵĻ����ΪƯ�۵���Ҫ�ɷ֣��Ȼ�����Ư�����ã�����Ư�۵���Ч�ɷ�Ϊ������ƣ�������ǿ�����Զ���ɱ������������,��Ч�ɷֵĻ�ѧʽΪCa(ClO)2;�𰸣�Ca(ClO)2��
��4�����ά�ijɷ�Ϊ�������裬�仯ѧʽΪSiO2���𰸣�SiO2��
��5���մɡ�ˮ��Ͳ����dz��õĴ�ͳ�����ǽ������ϣ���ͨ��������ȡ�Ǵ��ʯ��ʯ�ֱ��ڸ��µ������º�ʯӢ��Ӧ�����ɹ����ƺ���ơ�����������ͨ��������Ҫԭ���д��ʯӢ��ʯ��ʯ����Ϊ����������Һ��SiO2��Ӧ������װ����������Һ���Լ�ƿ�����ò��������仯ѧ��Ӧ����ʽΪ��SiO2+2NaOH=Na2SiO3+H2O��Na2SiO3����ճ���ԣ��𰸣����ʯӢ��ʯ��ʯ��SiO2+2NaOH=Na2SiO3+H2O��
��6��������ˮ��Һ�е��뷽��ʽΪKAl(SO4)2=K++Al3++2SO42-����������Al3+��SO42-�����Ժ� Ba(OH)2��Ӧ������KAl(SO4)2Ϊ2mol,��Һ�к���2molAl3+��4molSO42-����2molAl3+ǡ��ȫ������ʱ����Ҫ6molOH-��������3molBa(OH)2����Ӧ�����ӷ���ʽΪ��2Al3++3Ba2++6OH-+3SO42-=2Al(OH)3��+3BaSO4��;�ʴ�Ϊ:KAl(SO4)2=K++Al3++2SO42-��2Al3++3Ba2++6OH-+3SO42-=2Al(OH)3��+3BaSO4��
��7������10Al+6NaNO3+4NaOH�T10NaAlO2+3N2��+2H2O��Ӧ��֪��Alʧ3�����ӱ��AlO2-��2NO3-��10�����ӱ��N2�������ݵ�ʧ�����غ��֪ת�Ƶĵ�������Ϊ30�������Ե���ת������Ϊ30e-���䷽��ʽΪ��![]() ���𰸣�
���𰸣�![]() ��
��
����10Al+6NaNO3+4NaOH�T10NaAlO2+3N2��+2H2O��Ӧ��֪������Ӧ�����ɱ����3.36L N2����ת�Ƶĵ�����ĿΪ��![]() 10NA=1.5NA;�𰸣�1.5NA��
10NA=1.5NA;�𰸣�1.5NA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����101kPaʱ��H2��1mol O2����ȫȼ������2molҺ̬ˮ���ų�571.6kJ��������H2��ȼ����Ϊ___����ʾH2ȼ���ȵ��Ȼ�ѧ����ʽΪ___��
��2������֪��CH4(g)+H2O(g)=CO(g)+3H2(g) ��H= +206.2kJ��mol-1��CH4(g)+CO2(g)=2CO(g)+2H2(g) ��H=+247.4kJ��mol-1�����Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ��____��
������̬��̬ԭ���γ�1mol��ѧ���ͷŵ���������м��ܡ���֪�������м������ݣ���N2(g)+3H2(g)![]() 2NH3(g) ��H=__kJ��mol-1��
2NH3(g) ��H=__kJ��mol-1��
��ѧ�� | H-H | N-H | N��N |
����kJ��mol-1 | 436 | 391 | 945 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��������ˮϡ��1mol��L-1�İ�ˮ��0.01mol��L-1��������Һ��ϡ�ͣ����и����ֵ��ʼ�ղ�����ǣ� ��
A.![]() B.
B.![]()
C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ3Fe(s)��4H2O(g)![]() Fe3O4(s)��4H2(g)��ƽ�ⳣ��������˵����ȷ����
Fe3O4(s)��4H2(g)��ƽ�ⳣ��������˵����ȷ����
A. K��![]()
B. K��![]()
C. ����c(H2O)���Сc(H2)����ʹ�÷�Ӧƽ�ⳣ����С
D. �ı䷴Ӧ���¶ȣ�ƽ�ⳣ����һ���仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ������������й�˵����ȷ������ ��
A. 100mL12mol/LŨ������������MnO2���ȳ�ַ�Ӧ����Cl2������Ϊ0. 3 NA
B. 80gSO3�ڱ�״������ռ���ԼΪ22.4L
C. ��FeI2��Һ��ͨ������Cl2������1 mol Fe2��������ʱ��ת�Ƶĵ��ӵ���ĿΪNA
D. 5.4g����������������������Һ��ַ�Ӧ����H2������Ϊ0. 3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º��ݵ��ܱ������У��������淴Ӧ2NO(g)+O2(g)![]() 2NO2(g)������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����
2NO2(g)������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����
A. ����Ӧ����NO2�����ʺ��淴Ӧ����NO���������
B. ��Ӧ������ѹǿ����ʱ����ӳ����仯
C. ���������ɫ��dz���ֲ���
D. ���������ܶȲ���ʱ���ӳ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·������ϳɼ״���
��1����CO2�����״���
��֪��CO2��g��+3H2��g���TCH3OH��g��+H2O��l�� ��H=��akJmol��1��
2H2��g��+O2��g���T2H2O��l�� ��H=��b kJmol��1��
���ʾCH3OH��g��ȼ�յ��Ȼ�ѧ����ʽΪ��____________________��
��2����CO�����״���
��֪��CO(g)+2H2(g) ![]() CH3OH(g)����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�
CH3OH(g)����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�

�ٸ÷�Ӧ���ʱ䦤H__________0(�����������������)��
��T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1_______K2 (�� ������������������)��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���______________��
A�������¶� B�� ��CH3OH(g)����ϵ�з���
C��ʹ�ú��ʵĴ��� D�� ����He��ʹ��ϵ��ѹǿ����
��3���״���CH3OH����������ȼ�ϵ�أ��õ���Dz��ò���̼������Ϊ�缫��������ϡ������Һ��ֱ�Ӽ��봿����ļ״���ͬʱ��һ���缫ͨ����������������ĵ缫��Ӧʽ��________________________�����������ĵ缫��Ӧʽ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������걱���а»Ἢ��������ţΪ������Ƶ�����ţ��������Funiulele������һ���л���ļ���ʽҲ����ţ���ʳ�Ϊţʽ��ϩȲ����cowenynenynol������֪�����ĸ���ͬ��ԭ�ӻ�ԭ���ŵ�̼ԭ�ӣ���Ϊ����̼ԭ�ӡ������й�˵������ȷ���ǣ� ��
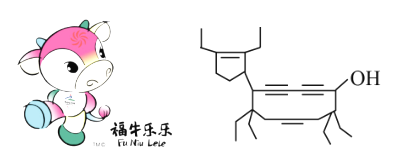
A.ţʽ��ϩȲ������3�ֹ����ţ��������ڲ����ʹ���
B.ţʽ��ϩȲ������3������̼ԭ�ӣ���������ȫ�ӳɷ�Ӧ����4������̼ԭ��
C.1molţʽ��ϩȲ��������6molBr2�����ӳɷ�Ӧ
D.ţʽ��ϩȲ���������ܷ�����ȥ��Ӧ��Ҳ�ܷ�����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������������̽��NH3�����ʡ�ʵ��ʱ��NaOH�����ϵμ���Ũ��ˮ����������һ������������档�±��ж�ʵ�����������Ľ�����ȷ����(����)

ѡ�� | ʵ������ | ���� |
A | Ũ���ḽ���������� | NH3��Ũ���ᷴӦ������NH4Cl���� |
B | Ũ���ḽ������������ | NH3��Ũ���������Ӧ |
C | �Ȼ�����Һ����� | ����Һһ����AlCl3��Һ |
D | �����ʯ����ֽ����ɫ��ʪ���ʯ����ֽ���� | NH3��һ�ֿ����Լ� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com