
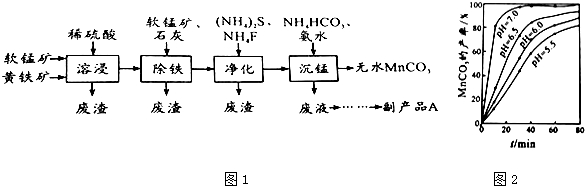
分析 由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸,FeS2和稀硫酸反应生成Fe2+,由沉锰后得到碳酸锰,可知酸性条件下二氧化锰被亚铁离子还原为Mn2+,过滤分离,再加入软锰矿将Fe2+氧化为Fe3+,加入CaO调节溶液pH,将Fe3+转化为Fe(OH)3除去,再过滤分离,加入硫化铵和氟化铵,除去溶液中的Cu2+、Ca2+等杂质,再过滤分离,在滤液中加入碳酸氢铵和氨水沉锰,生成MnCO3沉淀,过滤得到MnCO3,分液中主要含有(NH4)2SO4.
(1)根据Ksp(CaF2)=c2(F-)×c(Ca2+)计算;
(2)根据沉锰的图象可知,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果;
(3)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3过滤、洗涤、干燥即可得到碳酸锰;
(4)计算25mL溶液中剩余草酸钠消耗高锰酸钾物质的量,可得250mL溶液消耗高锰酸钾的物质的量,根据电子转移守恒计算二氧化锰的物质的量,进而计算样品中二氧化锰的质量分数.
解答 解:由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸,FeS2和稀硫酸反应生成Fe2+,由沉锰后得到碳酸锰,可知酸性条件下二氧化锰被亚铁离子还原为Mn2+,过滤分离,再加入软锰矿将Fe2+氧化为Fe3+,加入CaO调节溶液pH,将Fe3+转化为Fe(OH)3除去,再过滤分离,加入硫化铵和氟化铵,除去溶液中的Cu2+、Ca2+等杂质,再过滤分离,在滤液中加入碳酸氢铵和氨水沉锰,生成MnCO3沉淀,过滤得到MnCO3,分液中主要含有(NH4)2SO4.
(1)Ksp(CaF2)=1.46×10-10,c(F-)=0.01 mol•L-1,则c(Ca2+)=$\frac{1.46×1{0}^{-10}}{0.0{1}^{2}}$mol/L=1.46×10-6mol•L-1,
故答案为:1.46×10-6 mol/L;
(2)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:pH等于7.0时反应速率最快,且MnCO3的产率最高;
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥),用水洗去可溶性杂质,用乙醇洗去水分,低温干燥防止碳酸锰分解,
故答案为:先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥);
(4)n(C2O42-)=2.68g÷134g/mol=0.02mol;
滴定250mL稀释后溶液,消耗n(MnO4-)=0.0200mol/L×0.0200L×$\frac{250mL}{25mL}$=0.00400mol;
根据氧化还原反应中得失电子数相等得:n(MnO2)×2+0.00400mol×5=0.0200mol×2,
解得n(MnO2)=0.0100mol,
二氧化锰质量分数=$\frac{0.0100mol×87g/mol}{1.20g}$×100%=72.5%,
故答案为:72.5%.
点评 本题考查物质制备工艺流程,涉及溶度积常数计算、物质分离和提纯操作、图象分析、氧化还原反应滴定与计算等知识点,侧重考查学生分析理解能力与计算能力,需要学生具备扎实的基础.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:实验题
高纯氧化锌广泛应用于电子工业,某研究小组设计如下流程制备高纯氧化锌。
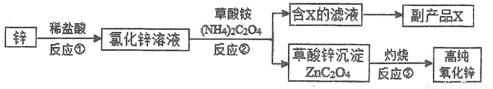
(1)反应①的化学方程式为___________________。
(2)反应②的基本反应类型是_____________。
(3)副产品X的化学式为:______________。从含X的滤液中获取固体X的实验操作步骤是:___________、____________、过滤。
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为_________、________。
(5)若用纯度为97.5%的1kg粗锌制备高纯氧化锌,理论上最多可生产出氧化锌的物质的量为:_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
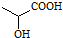 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 葡萄糖和乳酸含有相同的官能团 | |
| B. | 向葡萄糖溶液加入氢氧化铜悬浊液,加热一定有砖红色沉淀生成 | |
| C. | 乳酸能发生催化氧化、加成和取代反应 | |
| D. | 分子式C3H6O3,且含有羟基、羧基的有机物共有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:W<Z | |
| B. | 气态氢化物的稳定性:W>Z | |
| C. | 简单离子半径:Z>W>X>Y | |
| D. | X的氢化物中不可能含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 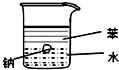 证明密度ρ(苯)<ρ(钠)<ρ(水) | B. | 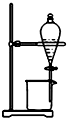 分离酒精和四氯化碳 | ||
| C. | 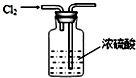 干燥Cl2 | D. | 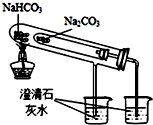 比较NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阴离子交换膜 | |
| C. | Y、Z、W、A元素性质均较为活泼,但其中的某些元素在自然界中仍可以游离态的形式存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com