
直接生成碳—碳键的反应是实现高效、绿色有机合成的重要途径。交叉脱氢偶联反应是近年来备受关注的一类直接生成碳—碳单键的新型反应,例如:
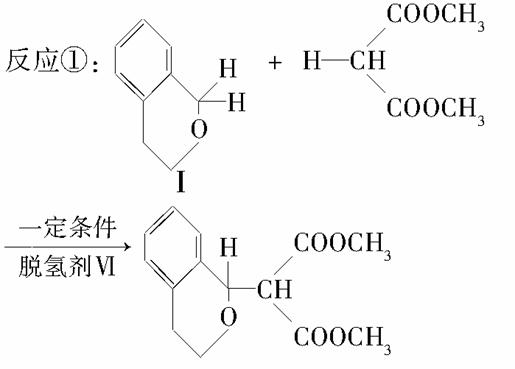
化合物Ⅰ可由以下合成路线获得:
Ⅱ(分子式为C3H8O2)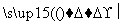 Ⅲ
Ⅲ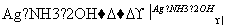
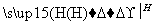 Ⅳ
Ⅳ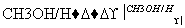 Ⅰ
Ⅰ
(1)化合物Ⅰ的分子式为__________,其完全水解的化学方程式为________________(注明条件)。
(2)化合物Ⅱ与足量浓氢溴酸反应的化学方程式为___________ (注明条件)。
(3)化合物Ⅲ没有酸性,其结构简式为__________;Ⅲ的一种同分异构体Ⅴ能与饱和NaHCO3溶液反应放出CO2,化合物Ⅴ的结构简式为__________。
(4)反应①中1个脱氢剂Ⅵ(结构简式如图) 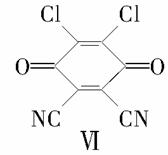 分子获得2个氢原子后,转变成1个芳香族化合物分子。该芳香族化合物分子的结构简式为__________。
分子获得2个氢原子后,转变成1个芳香族化合物分子。该芳香族化合物分子的结构简式为__________。
(5)1分子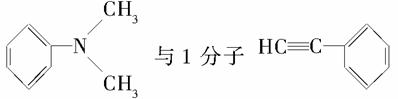 在一定条件下可发生类似反应①的反应,其产物分子的结构简式为____;1 mol该产物最多可与__________ mol H2发生加成反应。
在一定条件下可发生类似反应①的反应,其产物分子的结构简式为____;1 mol该产物最多可与__________ mol H2发生加成反应。
解析 根据Ⅰ的结构简式和合成路线可反推Ⅳ为HOOC—CH2—COOH,Ⅲ为OHC—CH2—CHO,Ⅱ为CH2OH—CH2—CH2OH。(1)酯类的完全水解是在碱性条件下进行的。(2)醇与卤化氢在加热条件下发生取代反应得到卤代烃和水。(3)OHC—CH2—CHO的同分异构体中,能与饱和NaHCO3反应生成CO2的分子中含有羧基(—COOH),根据分子式,分子中还含有一个碳碳双键,Ⅴ为CH2===CH—COOH。(4)根据信息可知,脱氢剂得到两个氢原子,接入分子中的羰基,同时羰基与环的化学键移位使分子中出现苯环,即得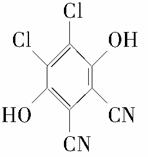 。(5)所给两个有机物中均只有一个位置出现烃基,各自脱去一个氢原子后结合即得产物
。(5)所给两个有机物中均只有一个位置出现烃基,各自脱去一个氢原子后结合即得产物
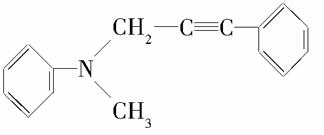 ,该有机物分子中含有2个苯环和1个碳碳叁键,1 mol该有机物最多能与8 mol H2发生加成反应。
,该有机物分子中含有2个苯环和1个碳碳叁键,1 mol该有机物最多能与8 mol H2发生加成反应。
答案 (1)C5H8O4 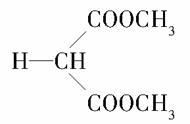 +2NaOH
+2NaOH NaOOC—CH2—COONa+2CH3OH
NaOOC—CH2—COONa+2CH3OH
(2)CH2OH—CH2—CH2OH+2HBr
CH2Br—CH2—CH2Br+2H2O
(3)OHC—CH2—CHO CH2===CH—COOH


科目:高中化学 来源: 题型:
一定温度下,在一固定容积的密闭容器中发生反应:2NO2(g)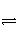
 N2O4(g),达平衡时,再向容器内通入一定量的NO2,重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
N2O4(g),达平衡时,再向容器内通入一定量的NO2,重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
A.不变 B.增大
C.减小 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.盐析可提纯蛋白质并保持其生理活性
B.根据燃烧时的气味,可以鉴别毛线和粘胶纤维
C.纤维素硝酸酯分子中含有C—N键
D.纤维二糖与乳糖互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
茉莉醛具有浓郁的茉莉花香,其结构简式如下所示: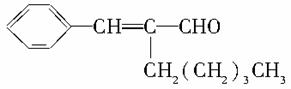 关于茉莉醛的下列叙述错误的是( )
关于茉莉醛的下列叙述错误的是( )
A.在加热、加压和催化剂作用下,能被氢气还原
B.能被高锰酸钾酸性溶液氧化
C.在一定条件下能与溴发生取代反应
D.不能与氢溴酸发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
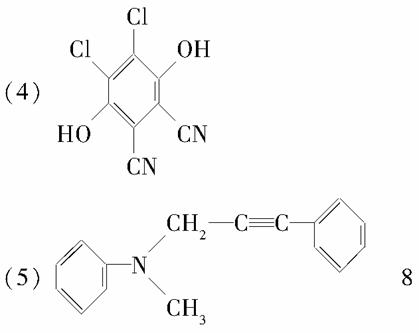
中药狼巴草的成分之一M具有清炎杀菌作用,M的结构如图所示: ,下列叙述正确的是( )
,下列叙述正确的是( )
A.M的相对分子质量是180
B.1 mol M最多能与2 mol Br2发生反应
C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4
D.1 mol M与足量NaHCO3反应能生成2 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
根据酸碱质子理论,下列物质为酸碱两性物质的有( )
①H2SO4 ②NaHSO3 ③NaOH ④Na2CO3 ⑤NH4H2PO4 ⑥CH3COOH
A.①②⑤⑥ B.③④⑤
C.①②⑥ D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
《中华人民共和国食品安全法》于2009年6月1日起实施。下列做法不利于食品安全的是( )
A.用聚氯乙烯塑料袋包装食品
B.在食用盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
查看答案和解析>>
科目:高中化学 来源: 题型:
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
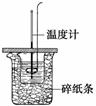
(1)大小烧杯间填满碎纸条的作用是_________________________________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将________(填“偏大”、“偏小”或“无影响”)。结合日常生活的实际该实验在______中进行效果更好。
(3)实验中改用60 mL 0.50 mol·L-1盐酸与 50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由__________________________________________
____________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________;用50 mL 0.5 mol·L-1 NaOH溶液进行上述实验,测得的中和热的数值会
________________________________________________________________________。
(均填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法正确的是
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com