
| A. | 1 mol NH2- 含有9 NA个电子 | |
| B. | 1.8 g的NH4+离子中含有的电子总数为NA | |
| C. | 0℃时,44.8L SO3含有的氧原子数为6 NA | |
| D. | 2.4 g金属镁变为镁离子时失去的电子数为0.1 NA |
分析 A、1个NH2- 中含有电子数为7+2+1=10;
B、依据n=$\frac{m}{M}$计算铵根的物质的量,然后判断电子个数;
C、0℃,SO3为液体;
D、1个镁失去2个电子变成镁离子.
解答 解:A、1个NH2- 中含有电子数为7+2+1=10,故1 mol NH2- 含有10 NA个电子,故A错误;
B、依据n=$\frac{m}{M}$=$\frac{1.8g}{18g/mol}$=0.1mol,1个铵根中含有电子数为7+4-1=10,故0.1mol铵根中含有电子数为NA,故B正确;
C、0℃,SO3为液体,不能利用标况下气体摩尔体积计算物质的量,故C错误;
D、2.4g镁的物质的量=$\frac{2.4g}{24g/mol}$=0.1mol,1个镁失去2个电子变成镁离子,故2.4 g金属镁变为镁离子时失去的电子数为0.2NA,故D错误,
故选B.
点评 本题考查了阿伏伽德罗常数的应用,主要考查阿伏伽德罗常数的规定,气体摩尔体积的条件应用,摩尔质量的概念判断,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 a mol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 其他条件不变向上述平衡体系中再充入lmolX,v(正)增大,v(逆)减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

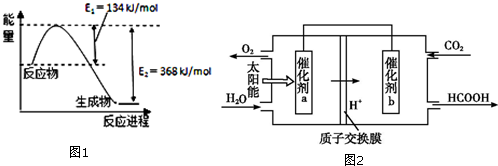
| 化学式 | HCOOH | H2CO3 | HCIO |
| 电离平衡常数 | 1.77×10-4 | Ki1=4.3×10-7 Ki2=5.6×10-11 | 3.0×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
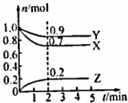 某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写:
某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
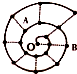 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )| A. | 同一虚线相连的元素离O点越远的原子半径越大 | |
| B. | A、B处于同一周期 | |
| C. | A元素是图中非金属性最强的元素 | |
| D. | A、B组成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镍基含铼单晶合金属于金属晶体 | |
| B. | ${\;}_{75}^{185}$Re和 ${\;}_{75}^{187}$Re互称为核素 | |
| C. | 铼(Re)元素的相对原子质量为186 | |
| D. | 含铼合金比纯铼的熔点高、硬度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
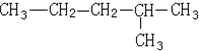
| A. | 该有机物属于饱和烷烃 | |
| B. | 该有机物可由两种单炔烃分别与氢气加成得到 | |
| C. | 该烃与2,3-二甲基丁烷互为同系物 | |
| D. | 该烃的一氯取代产物共有5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com