
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: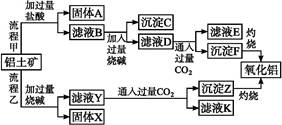
已知2Na2SiO3+2NaAlO2+2H2O Na2Al2Si2O8↓+4NaOH,请回答下列问题:
Na2Al2Si2O8↓+4NaOH,请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 。
(3)固体X的主要成分是 ,过滤时使用的玻璃棒,其作用是 。
(4)滤液B中溶质的主要成分是 (填化学式);滤液E、K中溶质的主要成分是 (填化学式),写出该溶液的一种用途 。
(5)在流程中,选用CO2作酸化剂,为什么不选用盐酸? 。
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:填空题
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图: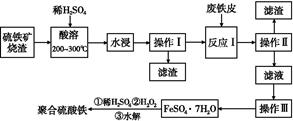
(1)实验室实现“操作Ⅰ”所用的玻璃仪器有 、玻璃棒和烧杯。“操作Ⅲ”系列操作名称依次为 、 、过滤和洗涤。
(2)“酸溶”过程中Fe3O4溶解的化学反应方程式为 。
(3)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 。
(4)实验室检验“反应Ⅰ”已经完全的试剂是 ,现象是 。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯氧化铁(α-Fe2O3)的工艺流程如下: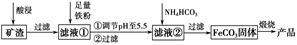
(1)“酸浸”过程中Fe3O4发生反应的离子方程式为______________________________。为提高“酸浸”中铁元素的浸出率,除了采用合适的液固比和循环浸取外,适宜的条件还有____________________、____________________。(任举两例)
(2)调节pH至5.5的目的是______________________________________。
(3)滤液②中加入NH4HCO3时需要控制反应温度不能过高,原因是__________________________________________________。(答一点即可)
(4)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。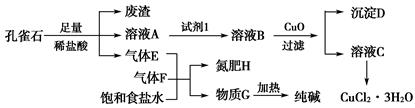
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
 Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下: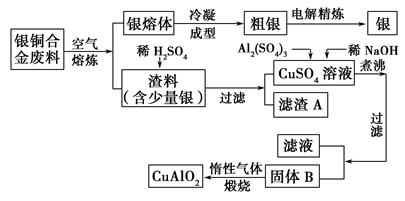
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。)
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3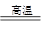 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下: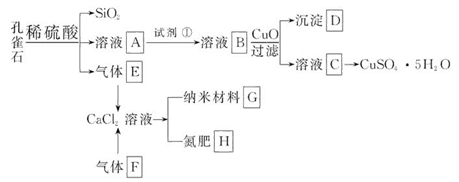
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中,试剂①最佳为_______(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.HNO3
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为______________。加入CuO的作用是_____________________。
(2)由溶液C获得CuSO4·5H2O,需要经过一系列操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是______________。
(3)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入) _______ (填化学式)。写出该反应的化学方程式_______________________________________。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应用_______ (填写仪器名称);取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
阅读材料,回答下列问题。
材料:近年来,科技人员研究得到一种新型材料——泡沫铝。它是把发泡剂加到熔融铝合金中制成的,其优点是硬度高,密度小(约为0.16~0.5 g/cm3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年可大批量投放市场。
(1)下列关于泡沫铝的说法错误的是 。
A.泡沫铝即是铝单质泡沫
B.泡沫铝是一种合金
C.泡沫铝是一种优质的建筑材料和轻质材料
D.泡沫铝可用于飞机制造
(2)铝制成铝箔作食品包装,是利用它的哪一性质 。
A.金属光泽 B.延展性 C.导电性 D.导热性
(3)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜遇到强酸或强碱都会溶解,请写出:
①与盐酸反应的离子方程式: ;
②与氢氧化钠溶液反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
把2.0 mol CuSO4和1.0 mol
CuSO4和1.0 mol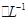 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度
(2)混合液中和的物质的量浓度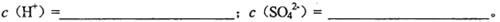
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度。c(Fe2+)=_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。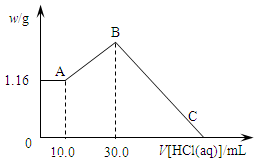
(1)A点的沉淀物的化学式为 。
(2)写出A点至B点发生反应的离子方程式: 。
(3)原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为 mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com