
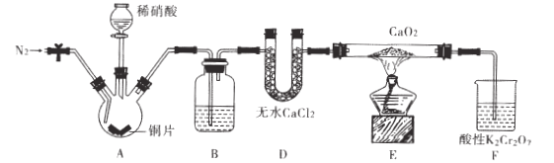
����Ŀ���������[ Ca(NO2)2]��ˮ���������Ӽ�����Ҫԭ�ϣ�ijѧϰС�����ʵ���Ʊ�����
��ƣ�ʵ��װ����ͼ��ʾ���г�װ����ȥ����
��֪��![]()
��ش��������⣺
��1����������ƿ�м���ϡ����֮ǰ��Ӧ��װ����ͨ��һ��ʱ���N2��ԭ����____��
��2������D��������_;B��ʢ�ŵ��Լ���____��
��3��װ��F�У�����K2Cr2O7��Һ�ɽ�ʣ���NO������NO3-����Һ�ɳ�ɫ��Ϊ��ɫ
(Cr3+)��������Ӧ�����ӷ���ʽ��____��
��4����֪Ca(NO2)2��Һ�豣�������ԣ���Ϊ������ᷢ����Ӧ������NO���塣���
ʵ��֤��E���������������____��
��5����ҵ�Ͽ���ʯ��������Ṥҵ��β������NO��N02����Ӧ�����ܾ���β�������ܻ��
Ӧ�ù㷺��Ca(NO2)2����Ӧԭ��ΪCa(OH)2+NO +N02=Ca(N02)2+H2O��
����n( NO)��n(NO2��>l:l����ᵼ�� ��
����n( NO)��n( NO2)<l l����ᵼ�� ��
���𰸡���1���ų�װ���е�O2����ֹ�����ɵ�NO����ΪNO2����2��U�θ���ܣ�����ˮ����3��![]() ����4��ȡ����E�з�Ӧ��Ĺ������Թ��У��μ�����ϡ���ᣬ�Թܿ��к���ɫ�������ɣ���5�����ŷ�������NO�������ߣ���Ⱦ����������Ʒ��Ca(NO3)2���ʺ�������.
����4��ȡ����E�з�Ӧ��Ĺ������Թ��У��μ�����ϡ���ᣬ�Թܿ��к���ɫ�������ɣ���5�����ŷ�������NO�������ߣ���Ⱦ����������Ʒ��Ca(NO3)2���ʺ�������.
�������������������1��������ƿ����ͭƬ��ϡ���ᷴӦ����NO��NO���ױ������е�����������������ͨһ��ʱ���N2��Ϊ�˸���װ���е�O2������Ϊ���ų�װ���е�O2����ֹ�����ɵ�NO����ΪNO2����2��D��U�θ���ܣ�A����ȡ��NO���ܺ��е�����������NO2������B��ʢ������ˮ���Գ�ȥNO�е�NO2����Ϊ��U�θ���ܣ�����ˮ����3��װ��F�У�����K2Cr2O7��Һ�ɽ�ʣ���NO������NO3-����Һ�ɳ�ɫ��Ϊ��ɫ(Cr3+)�����ݵ���غ㡢Ԫ���غ���ƽ����ʽ������ʽΪ��![]() ����Ϊ��
����Ϊ��![]() ����4��Ca(NO2)2��Һ�豣�������ԣ���Ϊ������ᷢ����Ӧ������NO���壬���ɵ�NO��������е�������Ӧ�õ�����ɫ����NO2����Ϊ����4��ȡ����E�з�Ӧ��Ĺ������Թ��У��μ�����ϡ���ᣬ�Թܿ��к���ɫ�������ɣ���5����ҵ����ʯ��������Ṥҵ��β������NO��N02����Ӧ�����ܾ���β�������ܻ��Ӧ�ù㷺��Ca(NO2)2����Ӧԭ��ΪCa(OH)2+NO +N02=Ca(N02)2+H2O������n( NO)��n(NO2��>l:l��NO�������ᵼ��NO��Ӧ����ȫ���ŷŵ���������Ⱦ��������Ϊ���ŷ�������NO�������ߣ���Ⱦ����������n( NO)��n( NO2)<l l����ᷢ������Ӧ����Ca(NO3)2����Ϊ����Ʒ��Ca(NO3)2���ʺ�������.
����4��Ca(NO2)2��Һ�豣�������ԣ���Ϊ������ᷢ����Ӧ������NO���壬���ɵ�NO��������е�������Ӧ�õ�����ɫ����NO2����Ϊ����4��ȡ����E�з�Ӧ��Ĺ������Թ��У��μ�����ϡ���ᣬ�Թܿ��к���ɫ�������ɣ���5����ҵ����ʯ��������Ṥҵ��β������NO��N02����Ӧ�����ܾ���β�������ܻ��Ӧ�ù㷺��Ca(NO2)2����Ӧԭ��ΪCa(OH)2+NO +N02=Ca(N02)2+H2O������n( NO)��n(NO2��>l:l��NO�������ᵼ��NO��Ӧ����ȫ���ŷŵ���������Ⱦ��������Ϊ���ŷ�������NO�������ߣ���Ⱦ����������n( NO)��n( NO2)<l l����ᷢ������Ӧ����Ca(NO3)2����Ϊ����Ʒ��Ca(NO3)2���ʺ�������.


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г�������ʵ�����A��B��һ���¶��·�����ӦA��g��+xB��g��2C��g�����ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı�Ӱ�췴Ӧ��һ��������������������ʵ����ʵ���Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯��ͼ��ʾ������˵������ȷ���ǣ� �� 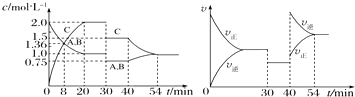
A.30��40 min��÷�Ӧʹ���˴���
B.��Ӧ����ʽ�е�x=1������ӦΪ���ȷ�Ӧ
C.30 minʱ�����¶ȣ�40 minʱ�����¶�
D.8 minǰA�ķ�Ӧ����Ϊ0.08 molL��1min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO��g��+2H2��g��![]() CH3OH��g�� ��H1
CH3OH��g�� ��H1
��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H2
CH3OH��g��+H2O��g�� ��H2
��CO2��g��+H2��g��![]() CO��g��+H2O��g�� ��H3
CO��g��+H2O��g�� ��H3
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼�����H1=______����֪��H2=��58 kJmol-1������H3=______��
��2���ϳ����е������Ƿ�չ�е�����Դ���������ð����Ʊ��������Ӧ���������ڡ���������ȣ�������Ϊȼ�ϵ��ŵ���__________________________________________________________��д�����㣩��ȱ����______________________________________________________________________��д�����㣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(��Ҫ��Ⱦ��SO2��NOx)��O3Ԥ��������CaSO3ˮ����Һ���գ��ɼ���������SO2��NOx�ĺ�����O3����������SO2��NOx����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ��NO(g)��O3(g)=NO2(g)��O2(g) ��H=��200��9kJ��mol��1 NO(g)��1/2O2(g)=NO2(g) ��H=��58��2kJ��mol��1 SO2(g)��O3(g)=SO3(g)��O2(g) ��H=��241��6kJ��mol��1
��1����Ӧ3NO(g)��O3(g)=3NO2(g)����H=_______mol��L��1��
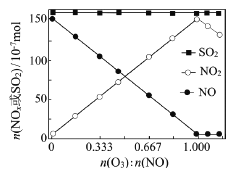
��2�����������̶����뷴Ӧ����NO��SO2�����ʵ������ı����O3�����ʵ�������Ӧһ��ʱ�����ϵ��n(NO)��n(NO2)��n(SO2)�淴Ӧǰn(O3)��n(NO)�ı仯����ͼ��
�ٵ�n(O3)��n(NO)>1ʱ����Ӧ��NO2�����ʵ�����������ԭ����_________________
������n(O3)��O3����SO2�ķ�Ӧ��������Ӱ���������ԭ����___________________��
��3������CaSO3ˮ����Һ���վ�O3Ԥ����������ʱ����Һ(pHԼΪ 8)��SO32����NO2ת��ΪNO2���������ӷ���ʽΪ��_________________________________________________________________________________
��4��CaSO3ˮ����Һ�м���Na2SO4��Һ���ﵽƽ�����Һ��c(SO32��)=_____________________________[��c(SO42��)��Ksp(CaSO3)��Ksp(CaSO4)��ʾ]��CaSO3ˮ����Һ�м���Na2SO4��Һ�����NO2���������ʣ�����Ҫԭ����__________________________________________________________________
��5���״�ȼ�ϵ���ڼ�����Һ�еĵ缫��Ӧʽ������_________________________________������____________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����(����)
A. �Ȼ�����Һ�м��������ˮ��Al3++4NH3��H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. ����ʯ��ˮ�������մ���Һ��ϣ�Ca2++OH-+HCO3-![]() CaCO3��+H2O
CaCO3��+H2O
C. ̼������ڴ��CaCO3+2H+![]() Ca2++CO2��+H2O
Ca2++CO2��+H2O
D. �Ȼ�������Һ��ͨ��������2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ˮƽ����ߣ�����Խ��Խ��������ɫʳƷ������ɫʳƷ��ָ(����)
A.��������ɫɫ�ص�ʳƷ
B.����Ҷ���ص�ʳƷ
C.ԭ������������û��ʹ�û��ʡ�ũҩ��ʳƷ
D.ԭ���������ӹ�������û���ܵ���Ⱦ��ʳƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��������֪���ʵ���Ũ��Ϊ0.1000mol/L��NaOH��Һ���ⶨδ֪���ʵ���Ũ�ȵ����ᣬѡ���̪��ָʾ��������д���пհף�![]()
��1����ͼ������������ ��
��2���ñ�������������Һ�ζ����������ʱ�����ּ�ѹ��Ƥ���в���С������ҡ����ƿ���۾�ע�� �� �ζ��յ���жϷ����� ��
��3����������������ݣ��ɼ�����������Ũ��ԼΪ��������λ��Ч���֣���
ʵ�� | NaOH��Һ�� | �ζ����ʱ����Һ��������/mL aOH | �����ε����/mL�� |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
��4��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ��� ��
A.�ζ��յ����ʱ���Ӷ���
B.��ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô������ᡢ��ϴ
C.��ƿˮϴ��δ����
D.��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H��C��N��O��F��Se��������Ҫ�ķǽ���Ԫ�ء��������ѧ�����ʽṹ�����ʵ����֪ʶ�ش��������⣺
��1����̬��ԭ������ܼ��ϵ��ӵ�����������________��,��̬��ԭ�ӵļ۲�����Ų�ʽΪ________��NԪ�ص�һ�����ܴ���OԪ�ص�һ�����ܵ�ԭ��Ϊ____________��
��2��ij��Ч�Ͷ�������ũҩ�Ľṹ��ʽΪ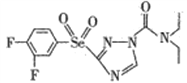 ,��������е�ԭ�ӵ��ӻ��������Ϊ________,�����֮��________�����������������������γ������
,��������е�ԭ�ӵ��ӻ��������Ϊ________,�����֮��________�����������������������γ������
��3��SeO2��SeO2���ַ�����,���ڷǼ��Է��ӵ���________,SeO2�Ŀռ乹��Ϊ________,��SeO3��Ϊ�ȵ�����ķ��Ӻ�����Ϊ________������дһ����
��4����������BN�������ж��ֽṹ,�����൪����������ṹ��ͼ1����ͨ�����ڵ��ȶ���,����������,�����൪����������ṹ��ͼ2���dz�Ӳ����,���������ĥ�ԡ�
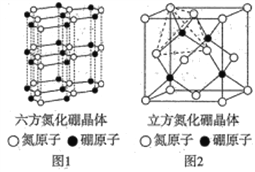
�����й��������־����˵����ȷ����________ ������ĸ����
a�����־�����ڵ���������ͬ b����������������������������иƬ
c�������൪������������С,�����ʵ��� d�������൪����������������,����Ӳ�ȴ�
����ͼ2�о����ı߳�Ϊanm,�ܶ�Ϊ��g��cm-3,���ӵ�������ֵΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У���Ҫ��������������
A��HCl�� H2 B��HCl ��FeCl2
C��H2SO4��Ũ����SO2 D��Fe��Fe2O3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com