
【题目】氯气是一种黄绿色气体.1974年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
(1)若用这两种方法制氯气,请比较,它们的发生装置使用的不同仪器是 .
(2)现将29g纯度为60%的软锰矿(主要成分MnO2)与足量的浓盐酸充分反应(杂质不参加反应),把反应后所得溶液稀释到200mL.计算:
①生成的Cl2在标准状况下的体积.
②稀释后溶液中MnCl2的物质的量浓度.
【答案】
(1)前者需要酒精灯加热,后者不需要
(2)
解:①29g纯度为60%的软锰矿(主要成分MnO2)中MnO2的物质的量为: ![]() mol=0.2mol,则:
mol=0.2mol,则:
MnO2+ | 4HCl(浓) |
| MnCl2+ | Cl2↑ | +2H2O |
1 | 1 | ||||
0.2mol | n(Cl2) |
所以n(Cl2)=0.2mol,故V(n(Cl2)=0.2mol×22.4L/mol=4.48L,
答:标准状况下生成的Cl2的体积为4.48L;
②消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2)=0.2mol,将反应后所得溶液稀释成200mL,稀释后液中MnCl2的物质的量浓度为 ![]() =1mol/L,
=1mol/L,
答:稀释后液中MnCl2的物质的量浓度为1mol/L
【解析】解:(1)软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,需在加热条件下进行;用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O,该反应无需加热,所以它们的发生装置使用的不同仪器是前者需要酒精灯加热,后者不需要,故答案为:前者需要酒精灯加热,后者不需要;
MnCl2+Cl2↑+2H2O,需在加热条件下进行;用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O,该反应无需加热,所以它们的发生装置使用的不同仪器是前者需要酒精灯加热,后者不需要,故答案为:前者需要酒精灯加热,后者不需要;
(1)根据反应条件确定制备装置的异同之处;(2)①根据质量分数计算软锰矿中二氧化锰的质量,再根据n= ![]() 计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;
计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;
②消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2),根据c= ![]() 计算稀释后液中MnCl2的物质的量浓度.
计算稀释后液中MnCl2的物质的量浓度.


科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x、y、z……表示)的原子半径相对大小、最高正价或最低负价的变化如下图所示。

请回答下列问题:
(1)f在周期表中的位置为______________;x形成的阴离子的结构示意图为_____________________。
(2)比较d、e常见离子的半径大小:__________________(填化学式,下同);比较g、h的最高价氧化物对应水化物的酸性强弱:_______________________。
(3)x、y、z、d四种元素能形成多种化合物。
①能形成离子化合物,其中一种x、y、z、d四种原子的个数比为5∶2∶1 ∶4,其化学式为__________________________。
②能形成共价化合物,写出其中一种的结构简式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列要求,写出有关反应的化学方程式
(1)实验室制取氢气______________。
(2)用化学方法除去铜粉中的氧化铜________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知:4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。


(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①平衡时,甲容器中CO的转化率是____________。比较下列容器中CO的转化率:乙________甲;丙________甲(填“>”、“=”或“<”)。
②丙容器中,通过改变温度,使CO的平衡转化率增大,则温度____________(填“升高”或“降低”),平衡常数K__________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一些金属单质的发现与其金属活动性存在着某种必然的联系,你认为下列事件发生在铁器时代之前的是:①金属铝的冶炼;②青铜器时代;③金银的使用;④戴维发现金属钠;⑤15世纪中国使用锌铸币
A. ②③⑤ B. ②③ C. ①②③ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)铜原子在基态时的价电子排布式为__________。金属铜的结构形式为面心立方最密堆积,晶胞中每个铜原子周围最近的铜原子有________个。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度 加以解释_______________________。
(3)GaC13和AsF3的空间构型分别是:_________,_______。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为____________;
②[B(OH)4]-的结构式为_________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
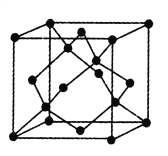
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是______________(用化学式表示);
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm (1pm=10-12m)。立方氮化硼的密度是______g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应的化学方程式为aFeCl2+bKNO3+ cHCl=d FeCl3+eKCl+f X+gH2O。若b=1,d=3,X为生成物,其分子式应为 ( )
A. NH4Cl B. NO2 C. NO D. N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com