
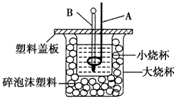
 已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.
已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.分析 (1)根据H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量;
(2)中和热测定中尽可能减少热量的散失,环形铜质搅拌棒会导致部分热量散失;为了减少热量的散失,将碱溶液一次性加入酸中;
(3)若保温效果不好,有热量散失,求得的中和热将会偏大;
(4)根据弱电解质电离吸热分析.
解答 解:(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知生成1molH2O放出热量为57.3kJ,0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应可得0.2molH2O,所以放出的热量为57.3kJ×0.2=11.46KJ,
故答案为:11.46;
(2)在测定中和热时,必须做好保温工作,环形铜质搅拌棒会导致较多的热量散失,影响测定结果;若分多次将碱溶液加入酸中,导致热量散失,最终最终测定及计算结果偏小;
故答案为:不能,铜棒易导致热量的散失;热量的散失;
(3)若保温效果不好,有热量散失,求得的中和热将会偏大,△H大于-57.3kJ•mol-1,
故答案为:实验过程中难免有热量散失;
(4)NH3•H2O为弱碱,电离过程为吸热过程,用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值偏小;
故答案为:偏小.
点评 本题考查热化学方程式的计算以及测定反应热的误差分析,难度中等,注意理解中和热的概念.


科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:选择题
下列实验方案设计中,可行的是
A. 加稀盐酸后过滤,除出去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物
D. 将O2和H2的混合物通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
某金属能和盐酸反应生成氢气,与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学家哈伯用催化法合成氨后,就能生产硝酸铵 | |
| B. | 化学家合成碳纳米管,用作分子导线和超小型电子器件 | |
| C. | 俄国科学家门捷列夫发现元素周期律 | |
| D. | 诺贝尔用硝化甘油制成了炸药,并用于工业生产 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 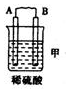 | 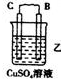 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列说法正确的是( )
下列说法正确的是( )| A. | FeO、Fe2O3和Fe3O4均为黑色固体 | |
| B. | 反应②③互为可逆反应 | |
| C. | 热稳定性顺序为:FeO>Fe2O3>Fe3O4 | |
| D. | 四氧化三铁中铁元素的化合价复杂,若写成氧化物的形式则化学式可写为FeO•Fe2O3,若视四氧化三铁为一种盐其化学式可写为Fe(FeO2)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则 反应过程中被破坏的碳碳双键的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com