
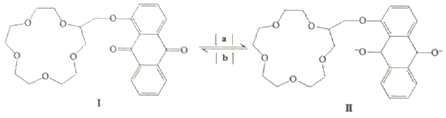
| A. | 物质Ⅰ的分子式是C25H28O8 | B. | 反应是氧化反应 | ||
| C. | 1molⅠ可与8molH2发生加成反应 | D. | 物质Ⅰ的所有原子不可能共平面 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
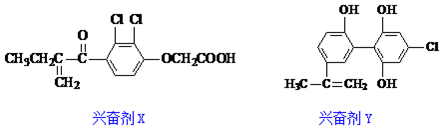
| A. | Y遇到氯化铁溶液时显紫色,但不能使溴的四氯化碳溶液褪色 | |
| B. | X既可以发生氧化反应,又可以发生还原反应 | |
| C. | 1molX与足量氢气反应,最多可消耗6molH2 | |
| D. | 1molY分子中最多有8个碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的量,化学平衡向右移动 | |
| B. | 温度升高,化学平衡一定会发生移动 | |
| C. | 增大压强,缩小容器体积,化学平衡不移动 | |
| D. | 添加MnO2,化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 10:11 | C. | 4:1 | D. | 5:22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com