
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 同周期元素的原子半径以ⅦA族的为最大
B. 在周期表中0族元素的单质全部是气体
C. ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子,第一电离能越大
D. 所有主族元素的原子形成单核离子时的价数都和它的族数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强。
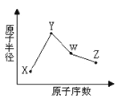
(1)W位于元素周期表中第 周期第 族。画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明强酸性溶液,可能含K+、NH4+、Al3+、Cu2+、Fe2+、SO42-、SiO32-、CO32-、NO3-等离子中的若干种,现做如下实验:
①取少量该溶液,加入足量用稀硝酸酸化的BaCl2溶液,有白色沉淀生成。
②另取①中上层澄清溶液,加入氢氧化钠溶液,生成沉淀的物质的量随NaOH溶液的体积变化的图象如下所示。
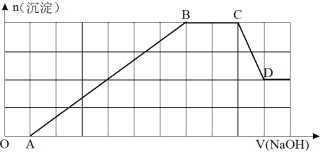
请完成下列问题:
(1)原溶液中一定存在(H+、OH-不必写出)___________,一定不存在________________,可能存在____________。
(2)原溶液中肯定含有的阳离子(H+除外)物质的量之比为________________。
(3)步骤①中若有氧化还原反应请写出对应离子方程式(若无,填写“无”)________________。
(4)若已知步骤②中最终形成1mol沉淀。现取原溶液加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙烯可被酸性高锰酸钾溶液氧化为CO2。可以用来除去甲烷中混有的少量乙烯的操作方法是( )
A.将混合气体通过盛有硫酸的洗气瓶
B.将混合气体通过盛有足量溴水的洗气瓶
C.将混合气体通过盛有水的洗气瓶
D.将混合气体通过盛有酸性高锰酸钾的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
I1 | I2 | I3 | I4 | |
电离能(kJ·mol-1) | 578 | 1 817 | 2 745 | 11 578 |
元素M是____________(填写元素符号),该元素属于___________区。
(2)硫原子核外有________种不同运动状态的电子,其基态原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
II.下图为几种晶体或晶胞的示意图:

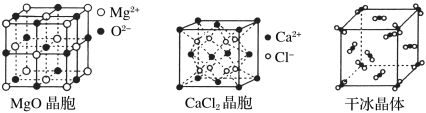
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为__________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“>”或“<”)MgO晶体。
(4)每个Cu晶胞中实际占有____个Cu原子,CaCl2晶体中Ca2+的配位数为____。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的描述和相关知识均正确的是( )
物质及变化 | 描述 | 相关知识 | |
A | 碘化钾溶液滴到土豆片上 | 变蓝色 | 土豆片含淀粉 |
B | 煤的气化 | 化学变化 | 主要反应是碳与水生成水煤气等 |
C | 乙烯和苯 | 都能使溴水褪色 | 分子中含有相同的碳碳双键 |
D | 淀粉和纤维素 | 多糖 | 二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃
B.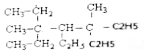 进行一氯取代反应后,能生成6种沸点不同的产物
进行一氯取代反应后,能生成6种沸点不同的产物
C.正戊烷分子中所有的碳原子均在一条直线上
D.分子式为C3H6、C6H12的两种有机物一定是同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com