
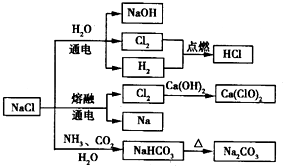
| A.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:不详 题型:单选题
| A.有氧化还原的分解反应 |
| B.无氧化还原的分解反应 |
| C.只是氧化还原反应 |
| D.只是分解反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,22.4 L苯中含有的分子数目为NA |
| B.25℃、101 kPa时,20 g SO3中含有的原子数目为NA |
| C.1 L 1 mol·L-1 MgCl2溶液中含有的氯离子数目为NA |
| D.16.8 g Fe与足量水蒸气反应,转移的电子数目为0.9NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1L 0.1 mol·L—1的CH3COONa溶液中CH3COO—的总数是0.1NA |
| B.常温常压下,1.6g O2和O3混合气体中质子总数为0.8 NA |
| C.一定条件下,2mol SO2和 1mol O2发生反应,转移的电子总数一定是4NA |
| D.1L 0.1mol·L—1的葡萄糖溶液中分子总数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O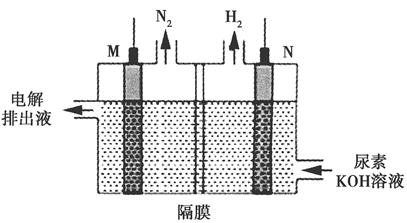
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述反应的产物Cu2HgI4中,Hg的化合价为+2 |
| B.上述反应中氧化剂是CuI |
| C.上述反应中Cu元素仅有一半被还原 |
| D.上述反应中生成64gCu时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 8SO2+2Fe2O3),通入沸腾炉中的气体原料是过量的空气,其中N2的体积分数为0.80,O2的体积分数为0.20,则沸腾炉排出的气体中SO2的体积分数可能是( )
8SO2+2Fe2O3),通入沸腾炉中的气体原料是过量的空气,其中N2的体积分数为0.80,O2的体积分数为0.20,则沸腾炉排出的气体中SO2的体积分数可能是( )| A.0.18 | B.0.12 | C.0.16 | D.0.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
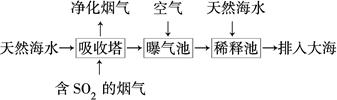
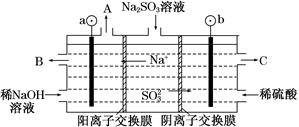
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.①③ | D.③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com