
 8.34g FeSO4?7H2O��Ʒ�ڸ�������������������ˮ���̵��������ߣ���Ʒ�������¶ȱ仯�����ߣ���ͼ��ʾ������˵������ȷ���ǣ�������
8.34g FeSO4?7H2O��Ʒ�ڸ�������������������ˮ���̵��������ߣ���Ʒ�������¶ȱ仯�����ߣ���ͼ��ʾ������˵������ȷ���ǣ�������| A���¶�Ϊ78��ʱ��������M�Ļ�ѧʽΪFeSO4?5H2O | ||||
| B���¶�Ϊl59��ʱ��������N�Ļ�ѧʽΪFeSO4?3H2O | ||||
C���ڸ���������������N�õ�P�Ļ�ѧ����ʽΪFeSO4
| ||||
| D��ȡ����380��ʱ���õ���ƷP����������������650�棬�õ�һ�ֹ�������Q��ͬʱ��������ɫ�������ɣ�Q�Ļ�ѧʽΪFe2O3 |
| 8.34g |
| 278g/mol |
| 0.72g |
| 16g/mol |
| 8.34g |
| 278g/mol |
| 2.16g |
| 18g/mol |
| 0.54g |
| 18g/mol |
| ||
| 0.72g |
| 16g/mol |


 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ˮ�����c��H+������=��=��=�� |
| B�����ڡ�����Һ��Ϻ�pH=7��������Һ��������ڣ��� |
| C��������Ģ١��ڡ�����Һ�ֱ����������۷�Ӧ������H2����������� |
| D������Һ�м���100mLˮ����Һ��pH���ۣ��ܣ��٣��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������£�9g H2O�к�NA��O-H�� |
| B��1 molFe2+������ϡ���ᷴӦ��ת��3 NA������ |
| C�����³�ѹ�£�22.4L SO2��O2�Ļ�������к�2NA����ԭ�� |
| D��1 L 0.1 mol?L-1��KAl��SO4��2��Һ��0.1NA��Al3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��11.2L����������Ļ�������к�NA����ԭ�� |
| B��31g���ף�����ʽΪP4���к���P-P���ۼ���ĿΪ1.5NA |
| C����״���£�22.4LSO2������ԭ�������еŵ��Ӷ���Ϊ2NA |
| D��1 molNa2O2��H2O��Ӧת�Ƶ��ӵ���ĿΪ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��FeSO4��Һ�У�K+��H+��Cl-��NO3- |
| B��c��OH-��/c��H+��=10-12����Һ�У�NH4+��Cu2+��NO3-��Cl- |
| C��ʹ���ȱ�Ƶ���Һ�У�Na+��K+��SO42-��AlO2- |
| D��������Ӧ������������Һ�У�K+��Ba2+��NO3-��HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �ŵ� |
| ��� |
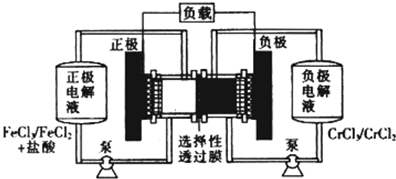
| A�����ʱ�������ĵ缫��ӦʽΪCr3++e-=Cr2+ |
| B����طŵ��⣬�����ĵ缫��ӦʽΪFe2+-e-=Fe3+ |
| C����طŵ�ʱ��Cl-�Ӹ����Ҵ���ѡ������Ĥ���������� |
| D���ŵ�ʱ����·��ÿ����0.1 mol���ӣ�Fe3+Ũ�Ƚ���0.1mol��L-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com