
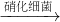 ______+______+______
______+______+______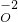 ,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1,所以离子方程式为NH4++2O2=NO3-+2H++H2O.
,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1,所以离子方程式为NH4++2O2=NO3-+2H++H2O.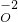 ,O元素化合价由0价降低为-2价,被还原的元素是O2中的O,电子由氮元素转移给氧元素,转移8个电子,
,O元素化合价由0价降低为-2价,被还原的元素是O2中的O,电子由氮元素转移给氧元素,转移8个电子,
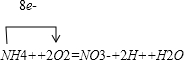 ;
; x
x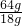 ×1mg×
×1mg× =4.57mg
=4.57mg ×2=0.6mol,所以n((NO3-)=0.2mol,根据N元素守恒有n(NH4+)=n(NO3-)=0.2mol,所以原溶液中NH4+的浓度为
×2=0.6mol,所以n((NO3-)=0.2mol,根据N元素守恒有n(NH4+)=n(NO3-)=0.2mol,所以原溶液中NH4+的浓度为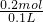 =2mol/L.
=2mol/L. ,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1.
,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1. ,根据(1)的离子方程式计算需要氧气的质量;
,根据(1)的离子方程式计算需要氧气的质量; 计算;
计算;

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:潍坊一模 题型:问答题
查看答案和解析>>
科目:高中化学 来源: 题型:
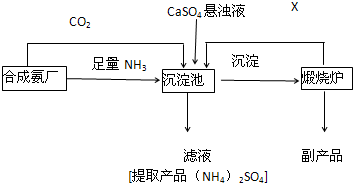
某化工厂为了综合利用废料 CaSO4 ,与相邻的合成氨厂设计了以下制备(NH4)2SO4 的工艺流程

请回答以下问题:
(1)沉淀池中发生的主要反应是(用化学方程式表示)
______________________________________________________
(2)从滤液中获取((NH4)2SO4晶体,必须的操作步骤是___________________(填写序号)
A.加热蒸干 B.蒸发浓缩 C.冷却结晶 D.过滤 E.萃取 F分液
(3)该生产过程中可以循环使用的X是__________________.
(4)在生产中,要检查输送氨气的管道是否漏气,可选用____________(填写序号)
A.浓盐酸 B.湿润的蓝色石蕊试纸 C.湿润的淀粉碘化钾试纸 D.稀硫酸 E.湿润的红色石蕊试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
某化工厂为了综合利用废料 CaSO4 ,与相邻的合成氨厂设计了以下制备(NH4)2SO4 的工艺流程

请回答以下问题:
(1)沉淀池中发生的主要反应是(用化学方程式表示)
______________________________________________________
(2)从滤液中获取((NH4)2SO4晶体,必须的操作步骤是___________________(填写序号)
A.加热蒸干 B.蒸发浓缩 C.冷却结晶 D.过滤 E.萃取 F分液
(3)该生产过程中可以循环使用的X是__________________.
(4)在生产中,要检查输送氨气的管道是否漏气,可选用____________(填写序号)
A.浓盐酸 B.湿润的蓝色石蕊试纸 C.湿润的淀粉碘化钾试纸 D.稀硫酸 E.湿润的红色石蕊试纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com