
(11分)已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题: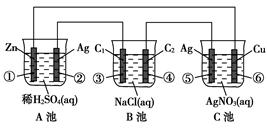
(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
(1)原电池 电解池 电镀池 (2)Zn-2e-==Zn2+ 2Cl--2e-==Cl2↑ Ag-e-==Ag+
(3)65 216 (4)C池
解析试题分析:由于两个电极活动性的差异最大的是Zn与Ag,所以A池是原电池。Zn是负极,发生氧化反应,Ag为正极,在正极上发生还原反应。相对其它池来说是电源。B池是电解池;C池是电解池。由于Ag电极与电源的正极连接,是阳极,Cu是与电源的负极连接的,是阴极。因此该池也就是电镀池。(2)①在Zn电极上发生反应: Zn-2e-==Zn2+;在③电极上Cl-放电,电极反应式是2Cl--2e-= Cl2↑;在⑤上由于Ag作阳极,所以是单质Ag失去电子,电极反应式是Ag-e-==Ag+。(3)当电路上有2 mol电子流过时,因为Zn是+2价的金属,所以有1mol的Zn发生氧化反应,所以①极上质量会减轻65g。在⑥极上会有质量变化2mol的Ag+得到电子,被还原,析出金属Ag,其质量为2mol×108g/mol=216g。(4)反应进行一段时间后,A池的电解质溶液会逐渐有H2SO4变为Zn SO4;B池会逐渐变为NaOH溶液;而在C池因为阳极产生Ag+离子,在阴极上是Ag+得到电子,被还原,所以仍然是AgNO3溶液, 浓度基本不变。选项为C。
考点:考查多个池串联时各个池的作用、电极反应、质量变化及溶液的浓度的变化情况的知识。


科目:高中化学 来源: 题型:单选题
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
| A.正极附近的SO42―离子浓度逐渐增大 |
| B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 |
| D.铜片上有H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)
(1)铅蓄电池中,作负极材料的金属在元素周期表中的位置是________________,写出其正极的电极反应式______________________________________________________;
(2)汽车尾气分析仪对 CO 的分析 以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2- 可以在固体介质中自由移动。
下列说法错误的是___________________。
| A.负极的电极反应式为:CO+O2-―2e=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【选修2化学与技术】(20分)
20-I(6分)下列有关叙述正确的是
| A.碱性锌锰电池中,MnO2是催化剂 | B.银锌纽扣电池工作时,Ag2O被还原为Ag |
| C.放电时,铅酸蓄电池中硫酸浓度不断增大 | D.电镀时,待镀的金属制品表面发生还原反应 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。 ’
①已知25℃.10lkPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1) △H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l 则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为 mol,此反应的化学方程式是 。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-。电池放电时,负极的电极反应为:
V2+-e一=V3+。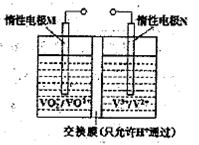
①电池放电时的总反应方程式为 。
充电时,电极M应接电源的 极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+) (填“增大”、“不变”或“减小”),阳极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
图为相互串联的甲、乙两电解池.试回答: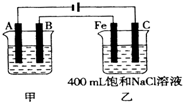
(1)若甲电解池利用电解原理在铁上镀银,则A是 (填电极材料),电极反应式 ;B(要求同A)是 ,电极反应式 ;应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 ,C极附近呈 。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是 。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol?L-1,溶液的pH等于 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学小组用下图装置电解CuCl2溶液制少量漂白液:

(1)其阳极的反应式是: ;导气管W端应与出气口 连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2( OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
能量之间可相互转化:
(1)电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。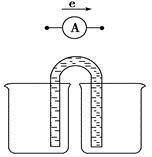
①完成原电池甲的装置示意图(见上图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是______________________________。
(2)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(1)的材料中应选__________作阳极。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
银器皿日久表面变黑,这是由于生成硫化银,有人设计用原电池原理加以除去,其方法是:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间,黑色会褪去而银不会损失。试回答:在原电池反应中,负极发生的反应为 ;正极发生的反应为 ;反应过程中有臭鸡蛋气味气体产生,则原电池的总反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com