
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A. 含有氢原子数为0.4NA的CH3OH分子中含有的共价键数目为0.5NA
B. a g某气体含分子数为b,c g该气体在标准状况下体积为![]() L
L
C. 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA
D. 常温下,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
【答案】C
【解析】A. CH3OH分子中含4个H原子,含5条共价键,故当含有氢原子数为0.4NA时,含有的共价键的条数为0.5NA,故A正确;B. 由于a g某气体含分子数为b,设c g该气体的分子个数为N,则有N=bc/a个,则气体的n=N/NA=bc/aNAmol,在标况下的气体体积V=nVm=22.4bc/aNAL,故B正确;C. 电解饱和食盐水,阳极产生气体的状态不明确,故22.4L气体的物质的量无法计算,则电路中通过的电子的数目无法计算,故C错误;D、常温下,pH=13的氢氧化钡溶液中,氢离子浓度为10-13mol·L-1,根据水的离子积可知氢氧根浓度c(OH-)=10-14/10-13=0.1mol·L-1,则1L溶液中含有的氢氧根的物质的量为0.1mol,个数为0.1NA个,故D正确。故选C。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】现有常温下4种溶液:①盐酸;②醋酸溶液;③氢氧化钠溶液;④氨水。已知①和②的pH为a,③和④的pH为b,且![]() b
b![]() 。则下列观点错误的是
。则下列观点错误的是
A.若![]() 时,则溶液④中水电离出的
时,则溶液④中水电离出的![]() 等于
等于![]()
B.若将①和③分别加水稀释100倍,则稀释后两溶液的pH之和仍为14
C.若将等体积的②和③分别与足量铝粉反应,生成的氢气后者多
D.若将①和④等体积混合,则混合后的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义,该反应为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
回答下列问题:
(1)0~5min时间内用H2表示的化学反应速率为___mol/(L·min)。
(2)达平衡时CH4的物质的量分数为___,CO2的转化率是___。
(3)反应前后混合气体的压强之比为___。
(4)为了加快反应速率,可采取什么措施___(写两条)。
(5)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
物质 | CH4 | CO2 | CO | H2 |
能量/kJ | 1660 | 1490 | 1072 | 436 |
该催化重整反应中反应物的总能量___生成物的总能量(填“大于”或“小于”)。
(6)下列能表示该反应已经达到化学平衡状态的是___。
A.v逆(CH4)=2v正(CO)
B.CO2的浓度保持恒定
C.混合气体平均相对分子质量不变
D.混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2 L Cl2溶于水,溶液中Cl-,ClO-和HClO的微粒数之和为NA
B.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.1 mol PC13与1 mol 36C12反应达到平衡时,产物中含P—36C1键数目为2NA
D.反应![]() +
+ ![]() →
→ ![]() +
+ ![]() 中,每生成294g
中,每生成294g ![]() 释放的中子数为3NA
释放的中子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
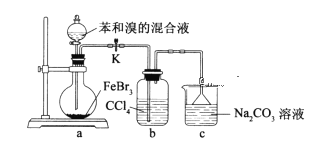
A.实验中装置b中的液体逐渐变为浅红色
B.装置c中的碳酸钠溶液的作用是吸收溴化氢
C.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图,下列叙述错误的是

A.冰表面第一层中,HCl以分子形式存在
B.冰表面第三层中,冰的氢键网格结构保持不变
C.冰表面各层之间,均存在可逆反应HCl![]() H++Cl
H++Cl
D.冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为0.9 g·cm3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列实验装置或操作的说法中,正确的是( )



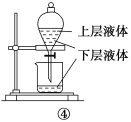
A.①可用于实验室用MnO2固体与浓盐酸共热,制取并收集干燥、纯净的Cl2
B.②实验中若左边棉花变橙色,右边棉花变蓝色,则能证明氧化性:Cl2>Br2>I2
C.③实验试管中会生成红色沉淀
D.用图④操作可提取碘水中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓度均为0.1 mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg V/V0的变化关系如右图所示。下列叙述正确的是
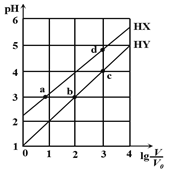
A. a、b两点的溶液中:c(X-)>c(Y-)
B. 相同温度下,电离常数K(HX):d>a
C. 溶液中水的的电离程度:d>c>b>a
D. lgV/V0=2时,若同时微热两种液体(不考虑挥发),则c(X-) /c(Y-) 增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com