

| ||


科目:高中化学 来源: 题型:
| A、氢键比分子间作用力强,所以它属于化学键 |
| B、冰融化成水的过程中,既破坏了范德华力又破坏了分子间氢键 |
| C、分子形成的氢键一定使物质的熔点和沸点升高 |
| D、测定100℃水蒸气的相对分子质量时发现实验值大于理论值,一定使实验操作不当引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(H+)=10-3mol/L |
| B、C(OH-)=10-9mol/L |
| C、pH=4 |
| D、溶液中由水电离的C(H+)=10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (其中R为烃基),相对分子质量为194.工业上以邻二甲苯(
(其中R为烃基),相对分子质量为194.工业上以邻二甲苯( )为原料先生产苯酐(
)为原料先生产苯酐( ),再使其与某醇在一定条件下反应可制得DMP.实验室由以下方法亦可得到DMP:
),再使其与某醇在一定条件下反应可制得DMP.实验室由以下方法亦可得到DMP: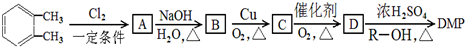
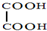 )在一定条件下可以按物质的量1:1发生反应可生成高分子化合物,反应的化学方程式为
)在一定条件下可以按物质的量1:1发生反应可生成高分子化合物,反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
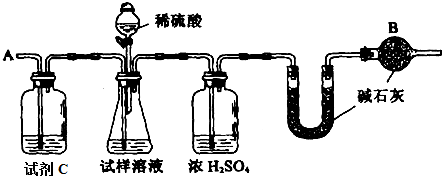
查看答案和解析>>
科目:高中化学 来源: 题型:
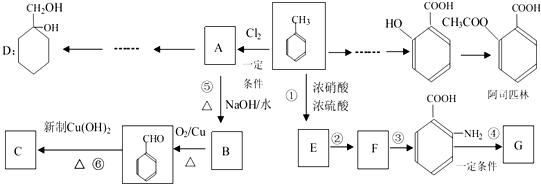
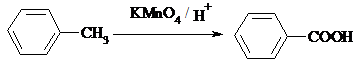
 (苯胺,易被氧化)
(苯胺,易被氧化) 的说法正确的是
的说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | ( | ( | |||
| ( | ( | ( | 平均值 | ||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com