
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________,表中b_________c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________mol·L-1,0~20s内N2O4的平均反应速率为________________;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
【答案】(每空2分,共12分)(1)N2O4![]() 2NO2,吸热
2NO2,吸热
(2)0.14, 0.003 mol/(L·s) (3)0.54 (4)ABD
【解析】
试题分析:(1)N2O4分解生成NO2,反应的化学方程式是N2O4![]() 2NO2。根据表中数据可知,反应进行到60s时,物质到浓度不再发生变化,说明反应达到平衡状态。当反应进行到反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,这说明降低温度反应写逆反应方向移动,因此正反应是吸热反应。
2NO2。根据表中数据可知,反应进行到60s时,物质到浓度不再发生变化,说明反应达到平衡状态。当反应进行到反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,这说明降低温度反应写逆反应方向移动,因此正反应是吸热反应。
(2)20s时,四氧化二氮的浓度为a
N2O4 ![]() 2NO2
2NO2
1mol/L 2mol/L
(0.20-a)mol/L 0.12mol/L
解得a=0.14mol/L
则反应的N2O4浓度为(0.2-0.14)mol/L=0.06mol/L
则反应速率v(N2O4)=0.06mol/L÷20s=0.003 mol/(L·s)
(3)平衡时NO2当浓度是0.22mol/L,则N2O4的浓度是0.2mol/L-0.11mol/L=0.09mol/L
所以根据反应的方程式可知,平衡常数K=![]()
(4)根据化学平衡常数知,K越大,生成物的浓度越大,反应物的浓度越小,N2O4的转化率大、NO2的产量越大、N2O4与NO2的浓度之比越小、正反应进行的程度越大,即选项ABD正确,答案选ABD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于胶体的叙述错误的是
A.溶液显电中性,胶体带有电荷,所以胶体较稳定
B.胶体粒子能透过滤纸,但不能透过半透膜,所以可用渗析的的方法精制胶体
C.可用丁达尔效应区分溶液和胶体
D.电泳实验说明了胶体粒子能吸附溶液中的阳离子或阴离子而带有电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素存在多种硫化物,兴趣小组为测定某铁硫化物(FeaSy)的组成按下列流程进行探究:
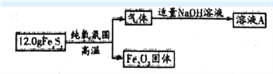
回答下列问题:
(1)测得Fe2O3固体的质量为8.0g,则FeaSy的化学式为______________。请设计实验检验Fe2O3中含有+3价铁:__________________________。
(2)铁硫化物在纯氧中发生反应的化学方程式为______________________________。
(3)兴趣小组同学推测溶液A中除含有Na2SO3外,还可能含有Na2SO4。设计实验方案并探究:
①用0.10 mol·L-1酸性KMnO4溶液应盛装在_______________(填“酸式“或“碱式”)滴定管中,然后进行滴定,反应的离子方程式为_________________________。
②确认A溶液中是否含有Na2SO4

请用化学方程式解释该方案不合理的原因____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氦-3聚变(3He+3He→4He+2H)可作为未来可控核聚变的清洁能源,下列说法正确的是
A.氦-3聚变属于化学变化B.3He和4He具有相同的质量数
C.He位于第1周期第ⅡA族D.2H和3He具有相同的中子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)用PbS熔炼铅的过程中会有如下反应发生:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=a kJ·mol-1
PbS(s) +2O2(g) =PbSO4(s) △H=b kJ·mol-1
PbS(s) +2PbO(s) =3Pb(s) +SO2(g) △H=c kJ·mol-1
写出PbS与PbSO4反应生成Pb和SO2的热化学方程式____________________。
(2)利用电解法也可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。

a电极的名称是__________,b电极的电极反应式为______________________,该生产过程中可以循环利用的物质是____________________。
(3)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:Pb+PbO2+2H2SO4![]() 2PbSO4 +2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
2PbSO4 +2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
(4)PbO2受热会随温度升高逐步分解。称取23.9g PbO2,将其加热分解,受热分解过程中固体质量随温度的变化如下图所示。

A点与C点对应物质的化学式分别为____________、_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种有机物的结构简式为R—CH=CH—COOH,式中的R为烷基,下列关于这种有机物的叙述中,错误的是 ( )
A. 若能溶于水,其水溶液与镁反应能放出氢气
B. 可以使溴水和酸性高锰酸钾溶液褪色
C. 可以与乙醇在一定条件下发生酯化反应
D. 不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)Cu2+(aq)+2Ag(s)设计的原电池如图所示:

请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________;
(2)银电极为电池的________极,发生的电极反应为__________________;X电极上发生的电极反应为________________;
(3)外电路中的电子是从________电极流向________电极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com