
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
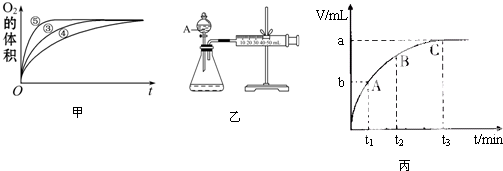
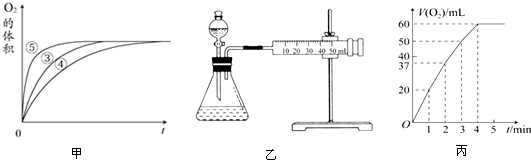
分析 (1)根据实验①和②的浓度不同进行判断;
(2)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答;
(3)该反应是通过反应速率分析的,所以根据v=$\frac{△v}{△t}$分析;
(4)根据双氧水在酸性条件下将亚铁离子氧化成铁离子写出反应的离子方程式;
(5)根据浓度对反应速率的影响分析.
解答 解:(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响,
故答案为:探究H2O2溶液的浓度的变化对分解速率的影响;
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:图象显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱;
(3)根据v=$\frac{△v}{△t}$知,还需要测定产生40mL气体所需的时间,
故答案为:测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率;
(4)H2O2能氧化H2SO4 酸化的FeSO4,反应生成了硫酸铁和水,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(5)随着反应的进行,双氧水的浓度越来越小,t3对应的C点气体体积达到最大量,基本反应完全,双氧水浓度最小,趋近于0,所以C点的瞬时反应速率最慢,
故答案为:C点的瞬时速率.
点评 本题考查影响化学反应速率的因素,较好的考查学生实验设计、数据处理、图象分析的综合能力,难度中等,注意信息的利用即可解答.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉中加入浓盐酸:ClO-+Cl-+2H+═Cl2↑+H2O | |
| B. | 氯化铁溶液洗涤银镜:Fe3++Ag═Fe2++Ag+ | |
| C. | 0.1 mol•L-1NH4HSO4溶液和0.1 mol•L-1NaOH等体积混合:NH4++H++2OH-═NH3•H2O+H2O | |
| D. | 0.1 mol•L-1的NaAlO2溶液和0.15 mol•L-1的H2SO4溶液等体积混合:AlO2-+4H+═Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
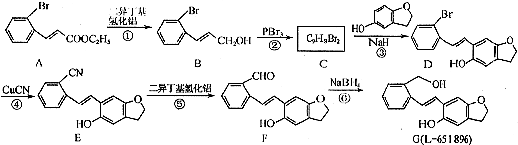
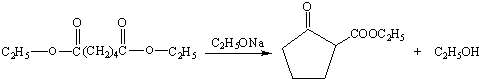
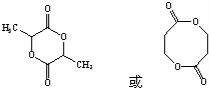
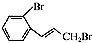 .
.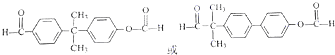 (只写一种).
(只写一种).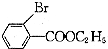 为原料制备二氢异苯并呋喃(结构简式如图
为原料制备二氢异苯并呋喃(结构简式如图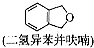 )的合成路线流程图(无机试剂可任选).
)的合成路线流程图(无机试剂可任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/L | B. | 1.4mol/L | C. | 1.7mol/L | D. | 1.9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的电子式: | |
| B. | 氯离子的结构示意图: | |
| C. | NaH与重水反应的化学方程式:NaH+D2=NaOH+D2 | |
| D. | 质量数为18的氧原子:${\;}_{6}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加铁粒质量 | B. | 换成同浓度的稀硫酸 | ||
| C. | 改成98%的浓硫酸 | D. | 加入纯硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
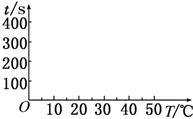 在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
在锌与盐酸反应的实验中,某同学得到的结果如下表所示:| 锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com