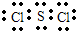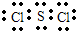原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V型分子,c的+1价离子比e的-1价离子少8个电子.
回答下列问题:
(1)元素a为______,c为______;
(2)由这些元素形成的双原子分子为______;
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线型的是______,非直线型的是______(写两种);
(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是______,离子晶体的是______,金属晶体的是______,分子晶体的是______;(每空填一种)
(5)元素a和b形成的一种化合物与c和d形成的一种化合物发生的反应常用于防毒面具,该反应的化学方程式为______.
【答案】分析:原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍,所以a是C元素;b和d的A2B型氢化物均为V型分子,且b的原子序数小于d的原子序数,所以b是O元素,d是S元素;c的+1价离子比e的-1价离子少8个电子,且都是短周期元素,所以c是Na元素,e是Cl元素.
解答:解:原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍,所以a是C元素;b和d的A2B型氢化物均为V型分子,且b的原子序数小于d的原子序数,所以b是O元素,d是S元素;c的+1价离子比e的-1价离子少8个电子,且都是短周期元素,所以c是Na元素,e是Cl元素.
(1)a是C;C是Na.
故答案为:C、Na.
(2)由这些元素形成的双原子分子为CO.
故答案为:CO.
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线形的是CO2,非直线形的是:H2O H2S.
故答案为:CO2;H2O、H2S.
(4)这些元素的单质或由他们形成的AB型化合物中,其晶体类型属于原子晶体的是金刚石,离子晶体的是NaCl,金属晶体的是Na,分子晶体的是 S 或CO.
故答案为:金刚石;氯化钠;钠;硫或一氧化碳.
(5)元素a和b形成的一种化合物是一氧化碳,与c和b形成的一种化合物是过氧化钠,二氧化碳和过氧化钠反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2.
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评:本题以元素 推断为载体考查了物质的结构和性质,能正确推断元素是解本题的关键,难度不大.