
����Ŀ������������Ԫ��V��W��X��Y��Z��ԭ����������������������Ԫ����ɵľ��������У�n��r��u�����嵥�ʣ������Ϊ�����n�ǻ���ɫ���壬m����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壬p����ɫҺ�壬q�ǵ���ɫ���塣���ǵ�ת����ϵ��ͼ��ʾ��

����˵����ȷ����
A. ʵ������ȡm��uʱ�����巢��װ�ÿ�����ͬ
B. ԭ�Ӱ뾶��W>X>Y
C. ��Ӧ�����ھ�Ϊ�û���Ӧ
D. n��t��Һ��Ӧʱ��t����ԭ��
���𰸡�A
��������n��r��u�����嵥�ʣ������Ϊ�����n�ǻ���ɫ���壬ӦΪ������m����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壬ӦΪNH3��p����ɫҺ�壬ӦΪˮ��q�ǵ���ɫ���壬ӦΪNa2O2����Na2O2��ˮ��Ӧ���ɵ�����uΪ������tΪNaOH�������Ͱ�����Ӧ���ɵ�rΪ������sΪ�Ȼ�泥��Ȼ�狀��������ƻ�ϼ������ɰ�����ˮ���Ȼ��ƣ�����vΪNaCl��A��ʵ������ȡNH3���Ȼ�狀���ʯ�һ�ϼ��ȣ���O2������غͶ������̻�ϼ������������ô��Թܼ���װ�ý��У���A��ȷ��B���ɷ�����֪����������Ԫ��V��W��X��Y��Z����ΪH��N��O��Na��Cl�������Ƶ�ԭ�Ӱ뾶�ڶ���������Ԫ�������N��O�˵������ԭ�Ӱ뾶С����ԭ�Ӱ뾶Na>N>O����B����C����Ӧ�����û���Ӧ������Ӧ��Na2O2��ˮ��Ӧ����������NaOH�ķ�Ӧ�����û���Ӧ����C����D��Cl2����NaOH����NaCl��NaClO��ˮ��Cl2������ԭ������������������D����ΪD��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ܶ�Ϊ1.18g/ml����������Ϊ36.5%Ũ��������250ml0.1mol/L��������Һ����ղ���ش��������⣺
��1������250ml0.1mol/L��������Һ��Ӧ��ȡ�������_________ml��Ӧѡ������ƿ�Ĺ��__________________ml��
��2������ʱ������ȷ�IJ���˳����________��
A����30mlˮϴ���ձ� 2��3�Σ�ϴ��Һ��ע������ƿ����
B������Ͳ��ȷ��ȡ�����Ũ�����������ز����������ձ��У��ټ�������ˮ��Լ30ml�����ò���������������ʹ���Ͼ���
C��������ȴ�������ز�����ע��250ml������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm��
a��BCAFED b��BCFED c��BCAED
��3������B�У�ʹ����Ͳ��ȡҺ��ʱ���߸��ӻ��������Һ��Ũ��__________��ƫ�ߡ�ƫ�ͻ���Ӱ�죩������E�м�ˮ�����̶��߸���δ�����____________
��4�������������������������ҺŨ�Ƚ��к�Ӱ�죨ƫ�ߡ�ƫ�ͻ���Ӱ�죩��
a��û�н���A����____________��
b��������ˮʱ���������˿̶�___________��
c������ʱ����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ӧ�У�������Ӧ�뻹ԭ��Ӧ��ͬ��Ԫ���н��е��ǣ� ��
A.Cl2+H2O?HCl+HClO
B.2KClO3 ![]() 2KCl+3O2��
2KCl+3O2��
C.2KMnO4 ![]() K2MnO4+MnO2+O2��
K2MnO4+MnO2+O2��
D.2H2O ![]() ?2H2��+O2��
?2H2��+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͨ����һ���ִ�ͨ���ֶΣ������ǹ��ά�ļ�ƣ�������ά����Ҫԭ����(�� ��)
A.ͭB.��
C.ʯӢɰD.ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij���Ƿ���ʽΪC6H12O6���������γɵ����ǵķ���ʽ��(����)
A. C18H36O8 B. C18H34O17
C. C18H32O16 D. C18H30O15
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��гּ������������ԣ��� 
��1���Ʊ�����ѡ�õ�ҩƷΪ����������̺�Ũ���ᣬ����صĻ�ѧ��Ӧ����ʽΪ�� ��
װ��B�б���ʳ��ˮ����������
��2�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ�������ǿ��������D�л���ͨ����������ʱ�����Կ�����ɫ��Һ��Ϊɫ����������װ��D��������Һ����װ��E�У����۲쵽�������� ��
��3��װ��F����������NaOH��Һ�������ȣ���д����Ӧ�Ļ�ѧ����ʽ�� ��
��4��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η���
a | b | c | d | |
�� | �������ɫ���� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
�� | ��ʯ�� | ��ˮ�Ȼ��� | Ũ���� | ��ˮ�Ȼ��� |
�� | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����͵��Ǵ�������Ҫ�ɷ֣����Ļ������ڹ�ҵ�Ͼ�����Ҫ��Ӧ�á�
��1���������з�Ӧд�����Ȼ�ѧѭ���ڽϵ��¶�����ˮ�ֽ��Ʊ��������Ȼ�ѧ����ʽ��________________
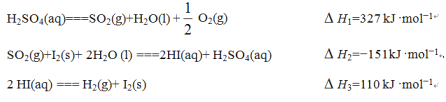
��2���ں����ܱ���������������ӦN2(g)��3H2(g) ![]() 2NH3(g)������˵������֤����Ӧ�Ѵﵽƽ��״̬����__________________��������ţ�
2NH3(g)������˵������֤����Ӧ�Ѵﵽƽ��״̬����__________________��������ţ�
�ٵ�λʱ��������n molN2��ͬʱ����2n molNH3
��1��N��N�����ѵ�ͬʱ����6��N��H���γ�
��1��N��N�����ѵ�ͬʱ����3��H��H���γ�
�ܻ��������ܶȲ��ٸı��״̬ �ݻ�������ѹǿ���ٸı��״̬
��������ƽ����Է����������ٸı��״̬��
Ϊ���H2��ת���ʣ�ʵ���������˲�ȡ�Ĵ�ʩ��________(����ĸ)��
A����ʱ�Ƴ��� B�����ʺϴ������Ե��ʵ�����
C���ʵ�����ѹǿ D��ѭ�����úͲ��ϲ��䵪��
E����Сѹǿ F�������¶�
��3���糧�����ѵ�������Ӧ���� 4NH3(g)��6NO(g)![]() 5N2(g)��6H2O(g)������Ӧ���� 2NH3(g)��8NO(g)
5N2(g)��6H2O(g)������Ӧ���� 2NH3(g)��8NO(g)![]() 5N2O(g)��3H2O(g)��ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ���������400K��600Kʱ��ƽ������������������ĺ������¶ȵı仯���ı��ԭ����_____________________________
5N2O(g)��3H2O(g)��ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ���������400K��600Kʱ��ƽ������������������ĺ������¶ȵı仯���ı��ԭ����_____________________________
��4����(N2H4)��һ����Ҫ�Ļ���ԭ�ϣ��ȿ�������ҩ���ֿ��������ȼ�ϡ���2 L�ĺ����ܱ������г���2mol N2H4��������ӦN2H4(g)![]() N2(g)+2H2(g)��
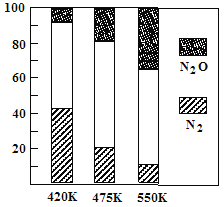
N2(g)+2H2(g)��![]() ����x��ʾ����ʱ��Ĺ�ϵ��ͼ1��ʾ������¶��£��˷�Ӧ��ƽ�ⳣ��K=_______________��
����x��ʾ����ʱ��Ĺ�ϵ��ͼ1��ʾ������¶��£��˷�Ӧ��ƽ�ⳣ��K=_______________��
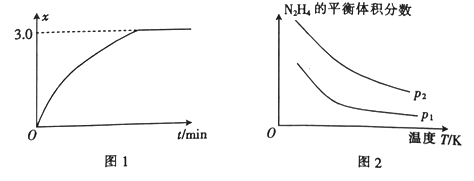
������һ������Ҳ�ɴﵽ�ֽ�ƽ�⣬ͬʱ�����������壬������һ��������ʹʪ��ĺ�ɫʯ����ֽ������ͼ2Ϊƽ����ϵ���µ�����������¶ȡ�ѹǿ�Ĺ�ϵ����p2_______ (��������������С����) p1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������з���Cm(H2O)n����ɣ����������������(����)
����ά�ء��ڼ���������۵��ۡ��ܼ�ȩ���ݱ��ᡡ������(���ǻ�����)�����Ҷ�����������
A. �ڢۢܢ� B. �ڢܢޢ� C. �٢ۢܢ� D. �ڢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ᴿ�������ʣ�������Ϊ���ʣ������������ˮ���������йس����Լ��ͷ��뷽����ѡ����ȷ���ǣ� ��
ѡ�� | ���ᴿ������ | �����Լ� | ���뷽�� |
A | CH3CH3��CH2=CH2�� | ��ˮ | ϴ�� |
B | CH3CH2Br��Br2�� | NaOH��Һ | ��Һ |
C | �屽������ | ���� | |
D | ��ϩ(�Ҵ�����) | ˮ | ϴ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com