
将铝粉与某铁的氧化物FeO•2Fe2O3粉末配制成铝热剂,分成两等份.一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为()
A. 11.20L B. 15.68L C. 22.40L D. 31.36L
考点: 有关混合物反应的计算;铝的化学性质;铁的氧化物和氢氧化物.
专题: 几种重要的金属及其化合物.
分析: 分成两等份.一份直接放入足量的烧碱溶液中,只有铝与氢氧化钠发生反应生成氢气, 15.68L为氢气体积,根据氢气的体积计算出铝的物质的量.另一份在高温下恰好反应完全,实质为铝置换出铁,铁的氧化物FeO•2Fe2O3中的氧原子全部与铝结合生成氧化铝,利用氧原子守恒,根据铝的物质的量,计算出氧原子的物质的量,再结合氧化物FeO•2Fe2O3的化学式计算出其物质的量,再根据铁原子守恒,可知生成的铁的物质的量.根据铁的物质的量计算铁与盐酸反应生成的氢气体积.
15.68L为氢气体积,根据氢气的体积计算出铝的物质的量.另一份在高温下恰好反应完全,实质为铝置换出铁,铁的氧化物FeO•2Fe2O3中的氧原子全部与铝结合生成氧化铝,利用氧原子守恒,根据铝的物质的量,计算出氧原子的物质的量,再结合氧化物FeO•2Fe2O3的化学式计算出其物质的量,再根据铁原子守恒,可知生成的铁的物质的量.根据铁的物质的量计算铁与盐酸反应生成的氢气体积.
解答: 解:一份直接放入足量的烧碱溶液中,铝与氢氧化钠发生反应生成氢气15.68L,
氢气的物质的量为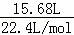 =0.7mol.
=0.7mol.
铁的氧化物FeO•2Fe2O3中的氧原子全部与铝结合生成氧化铝,
所以根据关系式3H2~~~~2Al~~~~3O~~~~Al2O3 3 2 3
0.7mol 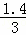 mol 0.7mol
mol 0.7mol
由于氧化物为FeO•2Fe2O3,根据氧原子守恒,所以氧化物FeO•2Fe2O3的为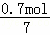 =0.1mol.
=0.1mol.
根据铁原子守恒,可知另一份生成的铁的物 质的量为0.1mol×5=0.5mol.
质的量为0.1mol×5=0.5mol.
根据Fe~H2可知,o.5molFe可生成氢气0.5mol,所以另一份生成的氢气的体积为0.5mol×22.4L/mol=11.2L.
故选:A.
点评: 考查混合物的计算、 铝的性质,难度较大,关键清楚反应过程.本解法在反应的基础上利用原子守恒,简化计算步骤,注意守恒思想的灵活运用.
铝的性质,难度较大,关键清楚反应过程.本解法在反应的基础上利用原子守恒,简化计算步骤,注意守恒思想的灵活运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物.
(1)为快速得到乙醇气体,可采取的方法是 ; 若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是 (填写编号);
a.取下小试管 b.移去酒精灯
c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中可能出现的现象为 .
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热.为了检验M的组成,进行下列实验.
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
②经检验溶液中有Fe2+和Fe3+;
关于M 中铁元素价态的判断正确的是d(填写编号).
a.一定有+3价和+2价铁,一定无0价铁 b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,一定无+2价铁 d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成.称取a g M样品进行定量测定,实验装置和步骤如下:
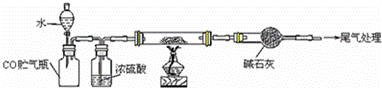
①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧….正确的操作顺序是 (填写编号)
a.①⑤④③②⑥⑦⑧b.①③⑤④②⑦⑥⑧c.①⑤③④②⑥⑦⑧d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中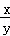 = .
= .
查看答案和解析>>
科目:高中化学 来源: 题型:
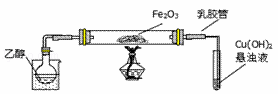
如图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉.填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.写出A中所发生有机反应的化学方程式:
(2)试管C中苯的作用是 .反应开始后,观察D和E两试管,看到的现象为 .
(3)反应2~3min后,在B中的NaOH溶液里可观察到的现象是 .
(4)在上述整套装置中,具有防倒吸作用的仪器有(填字母): .
查看答案和解析>>
科目:高中化学 来源: 题型:
农药波尔多液不能用铁制容器盛放,是因为铁能与该农药中的CuSO4起反应.在该反应中,铁是()
①氧化剂;②还原剂;③被氧化;④被还原.
A. ①③ B. ①④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件下,两瓶气体所含原子数一定相等的是()
A. 同质量、不同密度的N2和CO
B. 同温度、同体积的H2和O2
C. 同体积、同密度的C2H4和C3H6
D. 同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,B为常见金属或非金属单质,有下列转化关系:若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是()

A. AlCl3 B. H2O2 C. KCl D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为:
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号).
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是 (填代号).
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I﹣氧化为I2:S2O82﹣+2I﹣=2SO42﹣+I2.
通过改变反应途径,Fe3 +、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程: 、 (不必配平)
+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程: 、 (不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
a.除去Al3+的离子方程式是 .
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 .证明炉渣中含有FeO的实验现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学式为 .
已知:CO(g)+1/2O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1;S(s)+O2=SO2(g)△H=﹣296.0kJ•mol﹣1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2SO2 (g)+O2 (g)⇌2SO3(g)△H<0.甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol.
则T1>T2(填“>”“<”),甲容器中反应的平衡常数K= .
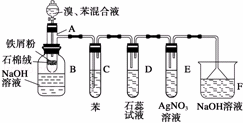
(3)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将1mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为N2(g)+3H2(g)⇌2NH3(g),起始时A、B的体积相同均为a L.
①图2示意图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是d.
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)= .
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为 (用c1、c2、c3和>、<、=表示).已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10﹣5 mol•L﹣1,则该温度下0.1mol•L﹣1的NH4Cl溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:选择题
下列物质属于电解质的一组是
A.CO2、NH3、HCl
B.H2SO4、HNO3、BaCl2
C.H3PO4、H2O、Cu
D.液态KNO3、NaOH溶液、C2H5OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com