
I.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题:
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
Ⅰ.(1)①0.13mol/(L·min)(2分) ②放(1分) 0.17(2分)
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH =-442.8 kJ/mol (2分)
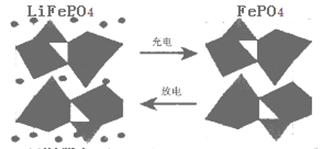
Ⅱ.(1)正(1分) FePO4+e-+Li+=LiFePO4 (2分) (2)0.168(2分) 2(2分)
解析试题分析:Ⅰ.(1)①由表格数据和反应的化学方程式可知可知,氢气的物质的量与CO2的物质的量是相等的,则二氧化碳的浓度变化为1.6mol÷2L=0.8mol/L,则v=0.8mol/L÷6min=0.13mol/(L·min);
②温度升高,氢气的含量减少,则升高温度平衡逆向移动,正反应为放热反应;
H2O(g)+CO(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
则K=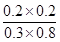 =0.17
=0.17
(2)已知在常温常压下:① 2CH3OH(l)+3O2(g)=2CO2(g)+ 4H2O(g) ΔH =-1275.6 kJ/mol、
② 2CO (g)+ O2(g)=2CO2(g) ΔH =-566.0 kJ/mol、③ H2O(g)=H2O(l) ΔH=-44.0 kJ/mol,则根据盖斯定律可知(①-②+③×4)÷2即得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH =-442.8 kJ/mol。
Ⅱ.(1)放电时铁元素的化合价由+3价降低到+2价,得到电子,因此是正极,电极反应式为FePO4+e-+Li+=LiFePO4;
(2)硫酸铜和氯化钠的物质的量均是0.01mol,由于通过0.02mol电子,因此铜离子青海方,氯离子不足,即氯离子完全放电后溶液中的氢氧根离子又放电。所以电解过程可以看做是3个阶段,度÷第一阶段相当于是电解氯化铜,第二阶段是电解硫酸铜,所以阳极产生氯气是0.01mol÷2=0.005mol,氧气是(0.02mol-0.01mol)÷4=0.0025mol,则体积共计是(0.005mol+0.0025mol)×22.4L/mol=0.168L。氧气是0.0025mol,则根据反应式2CuSO4+2H2O 2Cu+2H2SO4+O2↑可知产生氢离子的物质的量是0.0025mol×4=0.01mol,氢离子浓度是0.01mol÷1L=0.01mol/L,则pH=2。
2Cu+2H2SO4+O2↑可知产生氢离子的物质的量是0.0025mol×4=0.01mol,氢离子浓度是0.01mol÷1L=0.01mol/L,则pH=2。
考点:考查可逆反应的有关计算、盖斯定律应用以及电解原理的有关判断


科目:高中化学 来源: 题型:填空题
(17分)合成氨工业上常用下列方法制备H2:
方法:
方法:

试计算25℃时由方法②制备l000g H2所放出的能量为_________ kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应: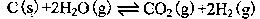 其相关数据如下表所示:
其相关数据如下表所示: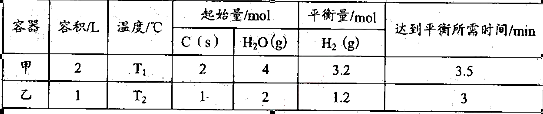
①T1_________T2(填“>”、“=”或“<”);
T1℃时,该反应的平衡常数K="_________" 。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是_________。
③一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.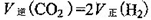
B.混合气体的密度保持不变
D.混合气体的平均相对分子质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示: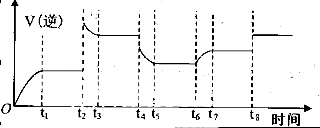
可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低_________,t4时刻改变的条件是__________。
⑤在25 ℃时,c mol/L,的醋酸与0.02mol/L NaOH溶液等体积混合后溶液刚好呈中性,
用含c的代数式表示CH3COOH的电离常数Ka=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
(1)写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
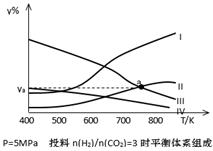
(2)对反应Ⅰ,在一定温度下反应达到平衡的标志是 (选填编号)
a.反应物不再转化为生成物 b.平衡常数K不再增大
c.CO2的转化率不再增大 d.混合气体的平均相对分子质量不再改变
(3)在密闭容器中,反应Ⅰ在一定条件达到平衡后,其它条件恒定,能提高CO2转化率的措施是 (选填编号)
| A.降低温度 | B.补充CO2 | C.加入催化剂 | D.移去甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式 。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
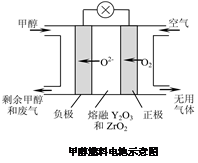
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)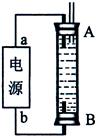
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积
为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
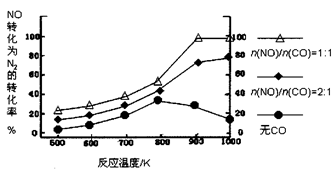
乙醇汽油含氧量达35%,使燃料燃烧更加充分,使用车用乙醇汽油,尾气排放的CO和碳氢化合物平均减少30%以上,有效的降低和减少了有害的尾气排放。但是汽车使用乙醇汽油并不能减少NOx的排放,对NOx的有效消除成为环保领域的重要课题。NOx排入空气中,形成酸雨,造成空气污染。NOx中有一种红棕色气体,其溶于水的方程式是 。
(2)已知NO2和N2O4的结构式分别是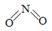 和
和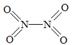 。
。
| 物质 | NO2 | N2O4 | |
| 化学键 | N=O | N—N | N=O |
| 键能(kJ/mol) | 466 | 167 | 438 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为 。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
标准状态下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是 。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)=CH4(g)的反应热ΔH为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)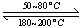 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
B.缩小容器容积,平衡右移, H减小 H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
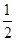 O2(g)=CO(g)
O2(g)=CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1 H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1 H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1 H= 。
H= 。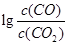 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。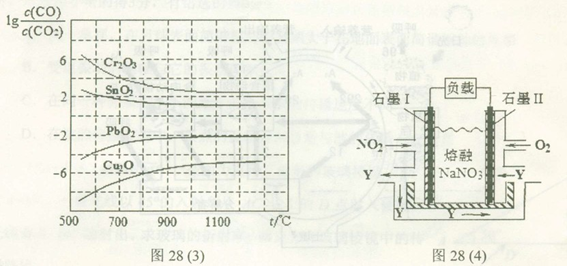
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①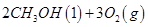 =
= mol
mol
② =
=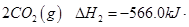 mol
mol
③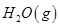 =
=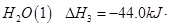 mol
mol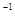
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)生产甲醇的原料CO和H2来源于下列反应: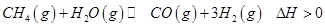
①一定条件下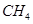 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则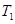
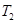 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(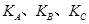 )的大小关系为 ;
)的大小关系为 ;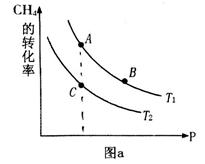
②100℃时,将1 mol 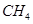 和2 mol
和2 mol 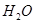 通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
a.容器的压强恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
c.容器内气体密度恒定
d.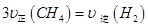
如果达到平衡时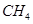 的转化率为0.5,则100℃时该反应的平衡常数K= 。
的转化率为0.5,则100℃时该反应的平衡常数K= 。
(3)某实验小组利用CO(g)、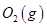 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。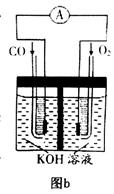
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
 N2(g)+3H2(g)的平衡常数K= 。
N2(g)+3H2(g)的平衡常数K= 。 2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com