
| A. | 凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0 | |
| D. | SO2与SiO2的晶体中,化学键种类和晶体类型均相同 |
分析 A.根据价层电子对互斥理论确定其杂化方式,如果价层电子对为2,则中心原子以sp杂化轨道成键,AB2型的共价化合物,其中心原子A不一定采用sp杂化轨道成键;
B.NH4+结合OH-使氢氧化镁溶解平衡正向移动,Mg2+增大;
C.反应自发进行的判断依据是:△H-T△S<0,分析选项是否符合要求;
D.一般非金属元素之间形成共价键,由分子构成的晶体为分子晶体,由原子构成的且为空间网状结构的晶体为原子晶体,以此来解答.
解答 解:A.AB2型的共价化合物,其中心原子A价层电子对为2,则中心原子以sp杂化轨道成键,如氯化铍分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心原子以sp杂化轨道成键,AB2型的共价化合物,也有不采用sp杂化轨道成键,如二氧化硫分子中,价层电子对数=2+$\frac{1}{2}$(6-2×2)=3,所以采取sp2杂化,故A错误;
B.氢氧化镁存在着微弱的电离,产生的氢氧根和氯化铵电离出来的铵根结合,产生一水合氨,使平衡正向移动,所以镁离子的浓度增加,故B正确;
C.2A(g)+B(g)=3C(s)+D(g)的△S<0,在一定条件下能自发进行,则△H-T△S<0,所以该反应的△H<0,故C错误;
D.SO2是分子晶体,SiO2是原子晶体,SiO2、SO2都只含共价键,故D错误;
故选B.
点评 本题考查了杂化轨道、沉淀溶解平衡、反应进行的方向、晶体类型等知识,题目难度中等,注意把握杂化轨道理论的应用,注意反应进行的方向的判断.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TNT的制备: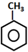 +3HNO3$→_{100℃}^{浓硫酸}$ +3HNO3$→_{100℃}^{浓硫酸}$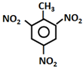 +3H2O +3H2O | |
| B. | 溴乙烷的消去反应:C2H3Br+NaOH$→_{△}^{水}$C2H4↑+NaBr+H2O | |
| C. | 乙醇氧化成乙醛:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | 乙酸乙酯在碱性条件下水解:CH3COOC2H5+H2O$?_{△}^{碱性}$CH3C0OH+C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4与稀硝酸反应:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 盐酸与醋酸钠溶液反应:H++CH3COO-═CH3COOH | |
| C. | 向FeI2溶液中通少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 向NH4Al(SO4)3溶液中加入少量氢氧化钠溶液:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cr的外围电子排布式:3d44s2 | B. | 氯化铯的晶体结构(晶胞)模型: | ||
| C. | CO2的电子式为: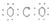 | D. | Na+的轨道表示式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液,c(NH4+)的大小顺序为:①>②>③ | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 0.2mol•L-1HCl与0.1mol•L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给容量瓶中加水时,借助于玻璃棒,给滴定管中装液时,借助于漏斗 | |
| B. | 用梨形分液漏斗做萃取实验时,检漏该分液漏斗上口的方法与检漏容量瓶一样,检漏下方活塞的方法与检漏滴定管一样 | |
| C. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较 | |
| D. | 蒸发操作时,蒸发皿必须放在石棉网上,用酒精灯的外焰加热;水浴加热可以不用温度计 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
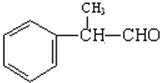 ,请回答以下问题:
,请回答以下问题: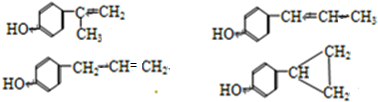
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的铝分别与足量氢氧化钠溶液和稀硝酸反应,放出的氢气一样多 | |
| B. | H2、SO2、CO2三种气体多可用浓硫酸干燥 | |
| C. | 自来水厂常用明矾对水进行消毒杀菌 | |
| D. | 将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com