
【题目】利用下图装置(略去部分夹持仪器,气密性己检验)生产硷代硫酸钠晶体(Na2S2O3·5H2O)。实验步骤是先向装置①的烧瓶中滴加80%的浓H2SO4;充分反应后过滤装置③中混合物,滤液经结晶即得到产品。
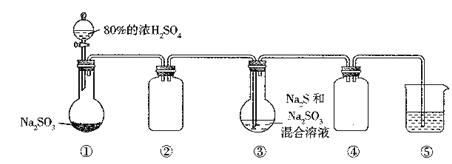
已知:2Na2S+Na2SO3+3SO2=3Na2S2O3。下列判断不正确的是
A. 应用装置①,利用H2O2和MnO2可制取少量O2
B. 实验过程中,装置②和装置④的作用相同
C. 装置③中⑤Na2S和Na2SO3的物须的量之比最好为1:2
D. 装置⑤中盛有NaOH溶液、可吸收多余的尾气
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW , 该温度下,将浓度为a mol/L的一元酸HA与b mol/L一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.混合溶液的pH=7
B.混合溶液中,c(H+)= ![]() mol/L
mol/L
C.a=b
D.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氧化物易引起环境行染,需要悉心研究。
(1)二氧化硫可用于催化氧化制硫酸。硫酸工业中,作为催化剂的V2O5对反应I的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,如图所示:

下列分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | a | 496 |
反应Ⅰ的△H=-98 kJ ·mol-1,则 a=____________。反应Ⅲ的化学方程式为______________。将2molSO2和1molO2充入密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(_____________)
2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(_____________)
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
350 | 5.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
A.b >e
B.415℃、2.0MPa时O2的转化率为60%
C.在一定温度和压强下,加入V2O5作催化剂能加快反应速率,提高SO3的体积分数
D.平衡常数K(550℃)>K(350℃)
(2)较纯的SO2,可用于原电池法生产硫酸。图中离子交换膜是________离子交换膜(填“阴”、“阳”)。

(3)研究发现,含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定吸收液的pH变化,结果如右图所示:

请解释曲线如图变化的原因_______________________________。
(4)取五等份SO3,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:3SO3(g)![]() (SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(_____)
(SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(_____)

(5)用Na2SO3溶液作为吸收液吸收SO2时,产物为NaHSO3,已知亚硫酸的两级电离平衡常数分别为Ka1、Ka2。则常温下NaHSO3溶液显酸性的充要条件为_____________。(用含为Ka1、Ka2的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子垃圾中含有大量的废弃塑料和重金属,工业上可以从电子废料(电脑主板和手机废件)中提取大量的金、银和铜,每吨电子废料中能够提取出130公斤铜,0.45公斤黄金和2公斤白银,提取流程如下:

请回答下列问题:
(1)“酸溶”过程中,王水与金反应的化学方程式为________________________。
(2)“萃取”过程中,将混合液分离所需要的主要仪器为____________________,该仪器在使用前必须进行的操作为____________________________。
(3)“还原Ⅰ”制备单质Ag的过程中,发生反应的本质是Zn和AgCl在电解质HCl中形成微电池,该过程的总反应为:2AgCl+Zn=2Ag+ZnCl2,则该电池正极的电极反应式为__________________________。
(4)滤渣的主要成分为Cu2(OH)2CO3,则“沉铜”过程中发生反应的离子方程式为______________________。
(5)滤液为NaCl、Na2CO3和NaHCO3的混合液,若上述三种物质的物质的量浓度相同,则溶液中各离子浓度的大小顺序为______________________。
(6)根据下表中数据,综合分析工业上进行“还原Ⅱ”过程中所选用的还原剂最好为______________。
物质 | 价格(元·吨-1) |
双氧水(含30%H2O2) | 3200 |
绿矾(含99.0%FeSO4·7H2O) | 1800 |
亚硫酸氢钠(含99.5%NaHSO3) | 2850 |
草酸(含99.0%H2C2O4) | 3000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物F(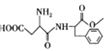 )是一种应用广泛可食用的甜味剂,俗称蛋白糖,它的一种合成路线如图所示。
)是一种应用广泛可食用的甜味剂,俗称蛋白糖,它的一种合成路线如图所示。
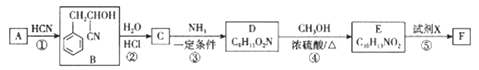
已知:Ⅰ.A能发生银镜反应
Ⅱ. ![]()
请回答下列问题:
(1)D中官能团的名称为_______________,F的分子式为___________________。
(2)A的名称为__________,反应③ 的反应类型为________________。
(3)反应④的化学方程式为_______________________。
(4)反应⑤中的另一种生成物是水,则X的结构简式为__________________。
(5)D有多种芳香族同分异构体,其中符合下列条件的有_________种(不考虑立体异构),
①与D具有相同的官能团 ②苯环上有2 个取代基
其中核磁共振氢谱为6组峰且峰面积比为2:2:2:2:2:1的结构简式为____________(写出一种即可)。
(6)丙烯酸是重要的有机合成原料及合成树脂单体,请写出以CH3CHO为原料合成丙烯酸的合成路线________________________ (其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂排出的主要固体废物,我国火电厂粉煤灰的主要氧化物组成为SiO2、A12O3、Fe2O3、CaO、MgO等、利用粉煤灰可制备污水处理的混凝剂(PAFC)及其他化工产品,其下艺流在如下:
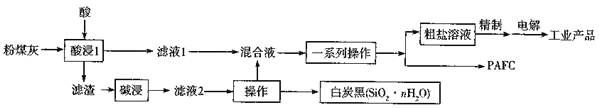
(1)PAFC名称是聚合氧化铝铁,其化学式为[Al2(OH)nCl6-n][Fe2(OH)NCl6-N]M,化学式中n、m、N、M均为整数。已知碱式氯化镁[Mg(OH)2·MgCl2],]可改写为氧化物和氯化物形式2MgO·2HCl,则PAFC改写为氧化物和氯化物形式为__________________。
(2)“酸浸”操作中加入的酸为_______(填字母)
a.稀硫酸 b.浓硫酸 c.稀盐酸 d.稀硝酸
为了提高“酸浸”速率,可采取的措施为___________________。(填两种即可)。
(3)“碱浸"用的是NaOH溶液。该反应的离子方程式为_______________。
(4)“粗盐溶液”“精制”后的“电解”操作中,阴极反应为________________。
(5)常温时,测得流程图中“粗盐溶液”中c(Ca2+)=c(Mg2+)=0.01mol/L,若溶液中阳离子的浓度为1.0×10-5mol/L时可认为该离子除去干净,则Mg2+除干净时的pH=___,此时Ca2+的浓度___。{忽略加入碱液所导致的溶液体积变化;Ksp[Ca(OH)2] =6.0×10-6,Ksp[Mg(OH)2]=2.0×10-11,1g2=0.31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1998年6月,我国科学家参与研制的阿尔法磁谱仪随美国发现号航天飞机升入太空,开始了探索宇宙中是否存在“反物质”和“暗物质”的研究工作。根据你所学的知识推测用于制造阿尔法磁谱仪核心部件的材料是( )
A.Fe3CB.Fe3O4C.Fe2O3D.FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。
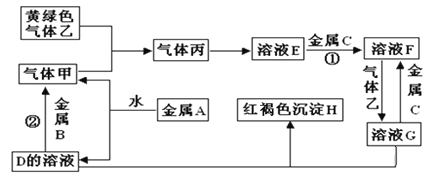
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:H_______________;乙______________。
(2)写出下列反应的离子方程式
反应①_________________________________________________________________
反应②_________________________________________________________________
(3)检验溶液G中的阳离子,可取少量溶液G于试管中,滴加KSCN溶液,现象是____________。检验溶液G中的阴离子,可另取少量溶液G于试管中,滴加__________(填化学式)溶液,现象是产生白色沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com