
分析 (1)n( HNO3)=2mol/L×0.1L=0.2mol,n( H2SO4)=1mol/L×0.1L=0.1mol,n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol.
溶液中n(H+)=0.2mol×1+0.1mol×2=0.4mol
n(NO3-)=0.2mol×1=0.2mol
①②根据离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,氢离子不足,故生成Cu2+、NO物质的量应根据H+的物质的量来计算;
③根据分析可知,若使金属铜完全反应,还缺少0.4mol氢离子,据此分析.
(2)溶液体积为200mL,而c(SO42-)+c(NO3-)=5.0mol•L-1,据此可知n(SO42-)+n(NO3-)=5.0mol•L-1×0.2L=1mol;
,而当混合酸溶液中n(H+):n(NO3-)=8:2=4:1时,所能溶解的铜的量最多,据此计算.
解答 解:(1)n( HNO3)=2mol/L×0.1L=0.2mol,n( H2SO4)=1mol/L×0.1L=0.1mol,n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol.
溶液中n(H+)=0.2mol×1+0.1mol×2=0.4mol n(NO3-)=0.2mol×1=0.2mol
①根据离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,氢离子不足,故生成Cu2+的物质的量应根据H+的物质的量来计算.设生成的铜离子的物质的量为xmol,则有:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
8 3
0.4mol xmol
故有:$\frac{8}{0.4mol}=\frac{3}{xmol}$
解得x=0.15mol
而反应后溶液体积为200mL,故反应后溶液中铜离子的物质的量浓度c=$\frac{0.15mol}{0.2L}$=0.75mol/L.
故答案为:0.75.
②根据离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,氢离子不足,故生成NO物质的量应根据H+的物质的量来计算,设生成的NO的物质的量为ymol,则有:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
8 2
0.4mol ymol
则有:$\frac{8}{0.4mol}=\frac{2}{ymol}$
解得y=0.1mol
在标况下的体积V=nVm=0.1mol×22.4L/mol=2.24L
故答案为:2.24;
③根据题干分析可知,若使金属铜完全反应,还缺少0.4mol氢离子,即需要的硫酸的物质的量为0.2mol,则需要的1mol/L H2SO4的体积V=$\frac{0.2mol}{1mol/L}$=0.2L=200mL
故答案为:200mL.
(2)由于混合溶液中c(SO42-)+c(NO3-)=5.0mol•L-1,且溶液体积为200mL,故有:n(SO42-)+n(NO3-)=[c(SO42-)+c(NO3-)]×0.2L=5.0mol•L-1×0.2L=1mol.
而当混合酸溶液中n(H+):n(NO3-)═8:2=4:1时,所能溶解的铜的量最多.
设混合溶液中硫酸的物质的量为xmol,硝酸的物质的量为ymol,当溶解的铜的质量最多时,有:
x+y=1 ①
$\frac{2x+y}{y}$=4 ②
解①②可得:x=0.6mol y=0.4mol
即溶液中n(NO3-)=0.4mol.
设所能溶解的铜的物质的量为zmol,则有:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3 2
zmol 0.4mol
则有:$\frac{3}{zmol}=\frac{2}{0.4mol}$
解得z=0.6mol
即最多溶解的铜的质量m=0.6mol×64g/mol=38.4g
故答案为:38.4.
点评 本题考查了混合溶液中化学方程式的有关计算,综合性较强,难度适中,是一道好题.解题时应注意的是铜虽然和稀硫酸不反应,但稀硫酸能为铜和硝酸根的反应提供氢离子.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 广州亚运会“潮流”火炬采用具有广州民间特色的象牙雕镂空工艺,以水的和谐与火的激情交相凝聚为理念,寄托了亚洲人民共同推进和平与发展的期望.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
广州亚运会“潮流”火炬采用具有广州民间特色的象牙雕镂空工艺,以水的和谐与火的激情交相凝聚为理念,寄托了亚洲人民共同推进和平与发展的期望.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气还原氧化铜 | |
| B. | 氢气在氧气中燃烧 | |
| C. | Ba(OH)2•8H2O与NH4Cl反应 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两容器内压强一定相等 | B. | 两容器中A的浓度一定相等 | ||
| C. | 两容器吸收或放出的热量一定相等 | D. | 两容器中B的百分含量一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{2}$L | B. | $\frac{a}{3}$L | C. | $\frac{a}{4}$L | D. | $\frac{a}{5}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始时观察到金属碎片表面有极少量气泡,可能原因为该金属片表面有氧化膜 | |
| B. | 过程中观察到金属碎片表面有大量气泡并在液面上“翻滚”,说明该合金碎片的密度小于该盐酸溶液的密度 | |
| C. | 该盐酸的物质的量浓度一定为4.0 mol•L-1 | |
| D. | 溶液X中Mg2+与Al3+的物质的量之比一定为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(l-) | amol | 0mol | 0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
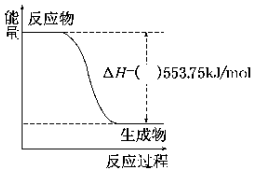
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | C(s)+O2(g)═CO2(g)△H=-285.5 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com