
 4NH3 (g)+3O2 (g) - Q �������Ӧ��ƽ�ⳣ��Kֵ��÷�Ӧ ��ѡ���ţ���
4NH3 (g)+3O2 (g) - Q �������Ӧ��ƽ�ⳣ��Kֵ��÷�Ӧ ��ѡ���ţ���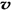 ��N2��/
��N2��/ 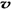 ��O2��=2:3
��O2��=2:3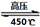 6H2O��+ 2N2��+ 4HCl��+ 5O2�����������������뻹ԭ��������ʵ���֮���� ��ÿ�ֽ�1mol������泥�ת�Ƶĵ�����Ŀ�� ��
6H2O��+ 2N2��+ 4HCl��+ 5O2�����������������뻹ԭ��������ʵ���֮���� ��ÿ�ֽ�1mol������泥�ת�Ƶĵ�����Ŀ�� �� 4NH3 (g)+3O2 (g) - Q ������Ӧ�����ȷ�Ӧ�������Ӧ��ƽ�ⳣ��Kֵ�����������Ũ������Ӧ��Ũ�ȼ�С������ A��һ��������Ӧ�����ƶ�����ȷ��B����ƽ���ƶ�ʱ����Ӧ������������С��˵��ƽ�����ƣ���ȷ��
4NH3 (g)+3O2 (g) - Q ������Ӧ�����ȷ�Ӧ�������Ӧ��ƽ�ⳣ��Kֵ�����������Ũ������Ӧ��Ũ�ȼ�С������ A��һ��������Ӧ�����ƶ�����ȷ��B����ƽ���ƶ�ʱ����Ӧ������������С��˵��ƽ�����ƣ���ȷ��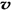 ��N2��/
��N2��/ 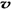 ��O2��=2:3������֮�ȵ��ڻ�ѧ������֮�ȣ���ȷ��
��O2��=2:3������֮�ȵ��ڻ�ѧ������֮�ȣ���ȷ��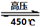 6H2O��+ 2N2��+ 4HCl��+ 5O2���У����������ǵ�������������ԭ�������Ȼ��⣬���ʵ���֮���� 7��4 ��ÿ�ֽ�1mol������泥�ת�Ƶĵ�����Ŀ�� 8NA �� 4.816��1024 ����
6H2O��+ 2N2��+ 4HCl��+ 5O2���У����������ǵ�������������ԭ�������Ȼ��⣬���ʵ���֮���� 7��4 ��ÿ�ֽ�1mol������泥�ת�Ƶĵ�����Ŀ�� 8NA �� 4.816��1024 ����

 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ӧ����Һ��c��NO3-����0.85 mol��L��1 |
| B����Ӧ�����Һ�����ܽ�1.82 g Fe |
| C����ӦǰHNO3��Һ��Ũ��Ϊ1.0 mol��L��1 |
| D��1.12 L������NO��NO2�Ļ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2O2����������H2O2�е���Ԫ�ر���ԭ |
| B��ÿ����1 mol O2ת�Ƶĵ��ӵ����ʵ���Ϊ4 mol |
| C��ClO2�е���Ԫ�ر����� |
| D��ClO2����������H2O2�ǻ�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2.50 | B��4.00 | C��7.50 | D��3.15 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

| A��Ϊ��һ����Ӧ�ṩ���ԵĻ��� |
| B��ʹKClO3ת��ΪKClO |
| C������ҺI�й�����Cl2������Ӧ�����ɸ����KClO |
| D��KOH�����ܽ�ʱ��ų��϶����������������߷�Ӧ���� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ԭ��Һ�к��еĽ���������ֻ��Fe2����Cu2�� |
| B���ù���ԭ��ʹ�õ�FeCl3��Һ�����ʵ���Ũ��ԼΪ2 mol/L |
| C������500 mL��Һ�м���������ϡHNO3��Һ���ڱ���²���NO����4��48 L����ԭ��Һ��Fe2����Cu2�������ʵ���Ũ��֮��Ϊ2:1 |
| D������ʹ�����軯����Һ����÷�Һ���Ƿ���Fe2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����NaOH��Ӧ������һ��Ϊ0.3 mol |
| B����Ӧ�����Һ��n��Na+����n��Cl-������Ϊ7��3 |
| C������Ӧ��ת�Ƶĵ���Ϊn mol����0.15��n��0.25 |
| D��n��NaCl����n��NaClO����n��NaClO3������Ϊ11�s2�s1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com