
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是 。
(3)反应Ⅱ的离子方程式为 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO 。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)将11.9 g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为 。
A.22.1 g B.27.2 g C.30 g D.无法确定
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
关于下列各装置图的叙述不正确的是( )
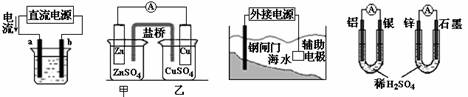
① ② ③ ④
A.用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B.图②装置的盐桥中KCl的Cl—移向甲烧杯
C.图③装置中钢闸门应与外接电源的正极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气后都首先发生置换反应
B.XCl3的溶液能与铜片发生反应,则铜的金属性一定比X强
C.非金属X能将Fe氧化到+3价,但非金属Y不能,则Y的氧化性一定比X强
D.Cl2和SO2等体积充分混合后,通入品红溶液,溶液颜色没有明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
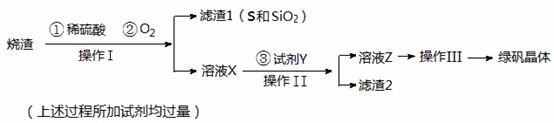
试回答:
(1)操作I为 (填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为 。
(3)操作III的顺序依次为: 、冷却结晶、过滤 、 、干燥。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需
②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)

③滴定时发生反应的离子方程式为: 。
④判断此滴定实验达到终点的方法是 ;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定
结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据下图图示判断,下列说法正确的是

A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:
c(Na+)>c(HAˉ)>c(H+)>c(A2-)>c(OHˉ)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加入水的过程中,pH可能增大也可能减小
查看答案和解析>>
科目:高中化学 来源: 题型:
居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料释放出的一种刺激性气味的气体,该气体是
A.CH4 B.NH3 C.HCHO D.SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3—O—CH3)和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列方法中不能对二者进行鉴别的是
A.利用金属钠或者金属钾 B.利用元素分析仪
C.利用红外光谱法 D.利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
课本介绍了乙醇催化氧化的实验。
(1)甲同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是①试剂: ②现象 。
③方程式 (用课本所学的知识回答)
(2)甲同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶 液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
Ⅰ.①溴与乙醛发生取代反应;② ③由于醛基具有还原性,溴将乙醛氧化为乙酸。请将猜想②填写完全。
Ⅱ.为探究哪种猜想正确,甲同学提出了如下两种实验方案:
方案一:用广泛pH试纸检测溴水褪色后溶液的酸碱性;
这种方法是否能判断出具体的反应原理 (填能或否)
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br— 离子的物质的量。
甲同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后
n(Br—)= mol,则说明溴与乙醛发生取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关碱金属铷(Rb)的叙述中,不正确的是 ( )
A.灼烧氯化铷时,火焰有特殊颜色 B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高 D.氢氧化铷是强碱碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com