
| A. | 乙烷 | B. | 异丁烷 | C. | 丁烷 | D. | 丙烷 |
分析 由题意可知,氢气的3物质的量为$\frac{4.4g-4g}{2g/mol}$=0.2mol,炔烃与氢气以1:2发生加成反应,则炔烃的物质的量为0.1mol,炔烃的平均摩尔质量为$\frac{4g}{0.1mol}$=40g/mol,结合平均值法判断,以此来解答.
解答 解:由题意可知,氢气的3物质的量为$\frac{4.4g-4g}{2g/mol}$=0.2mol,炔烃与氢气以1:2发生加成反应,则炔烃的物质的量为0.1mol,炔烃的平均摩尔质量为$\frac{4g}{0.1mol}$=40g/mol,只有乙炔的摩尔质量为26g/mol<40g/mol,丙炔的摩尔质量为40g/mol,其它炔烃的摩尔质量均大于40g/mol,则混合物中一定含乙炔,则加成得到的烷烃中一定含乙烷,
故选A.
点评 本题考查有机反应的计算,为高频考点,把握炔烃加成反应中物质的量关系、平均摩尔质量法等为解答的关键,侧重分析与计算能力的考查,注意平均值法应用,题目难度不大.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题
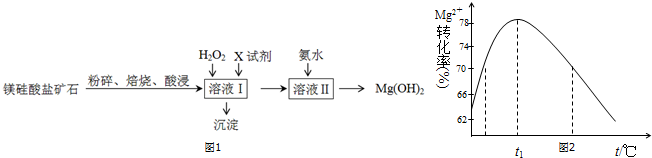
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去 | |
| C. | 漂白粉、活性炭、Na2O2都能使红墨水褪色 | |
| D. | 亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 | |
| B. | 不慎将苯酚沾到皮肤上应立即用酒精清洗 | |
| C. | 淀粉、蛋白质、油脂均是天然高分子化合物 | |
| D. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液、干燥、蒸馏即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 mol Cl2与足量NaOH溶液完全反应,转移的电子数2NA | |
| B. | 常温常压下,11.2 L CO2中含有的分子数是0.5NA | |
| C. | 标准状况下,22.4 L水所含原子数为3NA | |
| D. | 常温常压下,48 g O3和O2的混合气体中氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
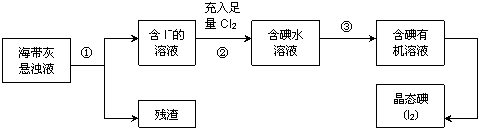
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵溶液与过量的氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+=Al3++3H2O | |
| C. | 二氧化硫和规律氢氧化钠溶液:SO2+OH-=HSO3- | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com