
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙).丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24.下列判断正确的是( )

|
| A. | 元素甲的简单气态氢化物稳定性比乙的强 |
|
| B. | 元素乙在周期表中的位置为第2周期,VIA族 |
|
| C. | 元素丙和元素丁的最高价氧化物对应的水化物均为强酸 |
|
| D. | 4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲 |
| 元素周期律和元素周期表的综合应用.. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | 甲、乙、丙、丁为四种短周期元素,由甲与乙、丙、丁在周期表中的位置关系可知,甲位于第二周期,原子序数:乙>丙,且丁的原子序数与乙、丙原子序数之和相等,故甲与丁处于同主族,甲与乙、丙处于同一周期,乙在甲的右侧相邻、丙在甲的左侧相邻,令甲的原子序数为x,则乙为x+1、丙为x﹣1,丁为x+8,则x﹣1+x+1=x+8,解得x=8,故甲为O、乙为F、丙为N、丁为S,结合元素周期律、原子结构来分析解答. |
| 解答: | 解:甲、乙、丙、丁为四种短周期元素,由甲与乙、丙、丁在周期表中的位置关系可知,甲位于第二周期,原子序数:乙>丙,且丁的原子序数与乙、丙原子序数之和相等,故甲与丁处于同主族,甲与乙、丙处于同一周期,乙在甲的右侧相邻、丙在甲的左侧相邻,令甲的原子序数为x,则乙为x+1、丙为x﹣1,丁为x+8,则x﹣1+x+1=x+8,解得x=8,故甲为O、乙为F、丙为N、丁为S, A.同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物的稳定性越强,F的非金属性大于O元素,所以乙的氢化物的稳定性大于甲,故A错误; B.乙原子核外有2个电子层,最外层电子数是7,则乙在周期表中位于第二周期第VIIA族,故B错误; C.丙为N元素,丁为S元素,硝酸和硫酸都是强酸,则元素丙和元素丁的最高价氧化物对应的水化物均为强酸,故C正确; D.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以离子半径为S2﹣>N3﹣>O2﹣>F﹣,故D错误; 故选C. |
| 点评: | 本题考查结构性质位置关系、元素周期律、半径比较等,难度中等,推断元素是解题的关键,注意离子半径大小的比较方法,先根据电子层数判断,如果电子层数相同时再根据电荷数判断,题目难度中等. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列反应中浓硫酸只表现强氧化性的是( )
A.2NH3+H2SO4(浓)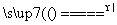 (NH4)2SO4
(NH4)2SO4
B.C+2H2SO4(浓)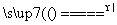 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
C.Cu+2H2SO4(浓)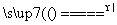 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.2FeO+4H2SO4(浓)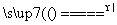 Fe2(SO4)3+SO2↑+4H2O
Fe2(SO4)3+SO2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
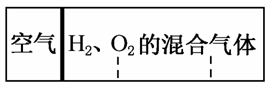
(2012·安徽联考)如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为( )
A.2:7 B.5:4
C.2:1 D.7:2
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,①6.72 L CH4气体 ②3.01×1023个HCl气体分子 ③13.6 g H2S气体 ④0.2 mol NH3,按下列要求对这四种气体的关系从大到小进行排列(用上述数字序号表示):
(1)标准状况下四种气体的体积 .
(2)四种气体的质量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(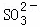 ):n(
):n(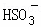 ) 变化的关系如表:
) 变化的关系如表:
| n( | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是( )
|
| A. | NaHSO3溶液中c(H+)<c(OH﹣) |
|
| B. | Na2SO3溶液中c(Na+)>c (SO32﹣)>c(HSO3﹣)>c(OH﹣)>c(H+) |
|
| C. | 当吸收液呈中性时,c(Na+)>c(SO32﹣)>c(HSO3﹣)>c(OH﹣)=c(H+) |
|
| D. | 当吸收液呈中性时,c(Na+)=c(HSO3﹣)+2c(SO32﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于材料的说法中,正确的是
A.光导纤维是信息社会必不可少的有机合成材料
B.棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水
C.航天飞机上的陶瓷防护片属于新型无机非金属材料
D.食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
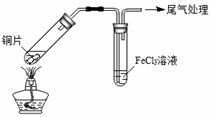
A B
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
| 步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是 。写出装置A中产生SO2的化学方程式: 。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因: 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式: 。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
| 步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为 。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有物质的量浓度均为0.1 mol·L-1 的① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25 mL,,下列说法正确的是 ( )
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①
D.若升高温度,则②的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com