
| A. | 氯气:Na+、Ba2+、HSO3-、I- | B. | 二氧化碳:Ca2+、NO3-、Ba2+、Cl- | ||
| C. | 氨气:Fe3+、Al3+、Na+、NO3- | D. | 二氧化硫:Ba2+、K+、NO3-、Cl- |
分析 A.氯气能够氧化亚硫酸氢根离子、碘离子;
B.四种离子之间不反应,通入二氧化碳后也不反应;
C.铁离子、铝离子在溶液中与氨气反应;
D.硝酸根离子在 酸性条件下能够将化二氧化硫氧化成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀.
解答 解:A.HSO3-、I-具有还原性,通入氯气后能够发生氧化还原反应,通入氯气后不能共存,故A错误;
B.Ca2+、NO3-、Ba2+、Cl-之间不发生反应,通入二氧化碳后也不反应,在溶液中能够大量共存,故B正确;
C.Fe3+、Al3+与通入的氨气反应,在溶液中不能大量共存,故C错误;
D.NO3-、在溶液中与二氧化硫发生氧化还原反应生成硫酸根离子,Ba2+与硫酸根离子反应生成硫酸钡沉淀,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,试题侧重对学生基础知识的训练和检验,有利于学生灵活运用基础知识解决实际问题的能力.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液和氢氧化钠溶液混合 HCO3-+OH-═CO32-+H2O | |
| B. | 向氯化铁溶液中投入铜粉 Cu+Fe3+═Fe2++Cu2+ | |
| C. | 少量的二氧化碳通入次氯酸钙溶液 Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓ | |
| D. | 铜与稀硝酸反应 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将28.4g Na2SO4溶于水配成1000mL溶液,溶液中c (Na+)的物质的量浓度为0.2mol/L | |
| B. | 80 mL 1 mol•L-1氯化钠溶液中的c (Na+)与40 mL 1 mol•L-1碳酸钠溶液中的c (Na+) 相等 | |
| C. | 0.5 mol•L-1NaCl和0.5mol•L-1Na2SO4两溶液相比较,Na+的物质的量之比为1:2 | |
| D. | 4 mol•L-1的NaCl溶液稀释成100 mL 0.2molL-1的NaCl溶液,需4 mol•L-1的NaCl溶液的体积为5.0mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化后,再检验 | |
| B. | 为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化 | |
| C. | 抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 鉴别溶液中是否有SO42-溶液可用盐酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个水分子的质量为18NA g | |
| B. | 常温常压下,22.4L氯气与足量金属钠充分反应,转移的电子数为2 NA | |
| C. | 1mol•L-1 CaCl2溶液中所含Ca2+离子的数目为NA | |
| D. | 通常状况下,32g 混合气体(O2和O3 )所含的氧原子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
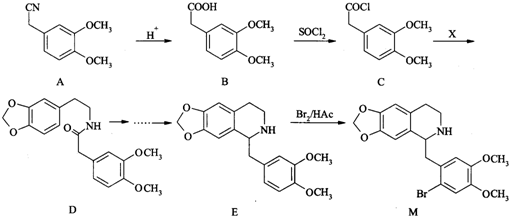
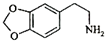 .
. .
.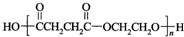 (聚丁二酸乙二酯)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
(聚丁二酸乙二酯)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
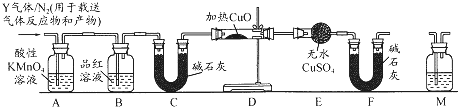
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
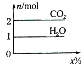 将甲,乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将甲,乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )| A | B | C | D | |
| 甲 | 戊烯 | 已烯 | 己二炔(C6H6) | 己烷 |
| 乙 | 环己烷(C6H12) | 苯 | 苯 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com