
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.各原子轨道的伸展方向按p、d、f的顺序分别为3、5、7 |
| B.核外电子云表示电子在核外单位体积的空间出现的机会多少 |
| C.原子轨道伸展方向与能量大小是无关的 |
| D.原子核外可能有两个电子的运动状态是完全相同的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
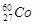 是γ射线放射源,可用于农作物诱变育种,我国用该方法培育出了许多农作物新品种,下列叙述正确的是
是γ射线放射源,可用于农作物诱变育种,我国用该方法培育出了许多农作物新品种,下列叙述正确的是| A.60是Co元素的相对原子质量 |
| B.由Co的不同种同位素组成的单质,其化学性质与物理性质均不同 |
C.60是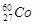 这种核素的质量数 这种核素的质量数 |
D.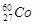 原子中,中子数是27,电子数是33 原子中,中子数是27,电子数是33 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | | | |||||||||||||||
| | | | | ① | ⑩ | ② | ③ | | |||||||||
| | ④ | ⑤ | | | ⑦ | ⑧ | ⑨ | ||||||||||
| | | | | | | | | | | | | | | | ⑥ | | |
| | | | | | | | | | | | | | | | | | |
 ________________________________________________。
________________________________________________。
 元素⑧单质能溶于水,水液呈 色,在其中通入元素⑦的某种氧化物,溶液颜色褪去,用化学方程式表示原因 。
元素⑧单质能溶于水,水液呈 色,在其中通入元素⑦的某种氧化物,溶液颜色褪去,用化学方程式表示原因 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| Q | 只有一种能级,其电子总数等于能层序数 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第2周期第ⅡA族 | B.第2周期第ⅢA族 |
| C.第3周期ⅣA族 | D.第3周期ⅥA族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 题:
题: 。
。
 在加热的条件下B、D形成的化合物的电子式为 ,其中的化学键的类型为 。
在加热的条件下B、D形成的化合物的电子式为 ,其中的化学键的类型为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 aO晶胞体积为 cm3
aO晶胞体积为 cm3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com