
| A. | 0.05mol•L-1 | B. | 0.1mol•L-1 | C. | 0.2mol•L-1 | D. | 0.3mol•L-1 |
分析 四氧化三铁中+2铁占$\frac{1}{3}$,3.48g四氧化三铁为0.015mol,完全溶解后溶液中含有Fe2+为0.015mol,入K2Cr2O7溶液25ml,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化成Cr3+,令K2Cr2O7的物质的量浓度为cmol/L,表示出Cr2O72-物质的量,根据电子转移守恒列方程计算c的值.
解答 解:四氧化三铁中+2铁占$\frac{1}{3}$,3.48g四氧化三铁物质的量为$\frac{3.48g}{232g/mol}$=0.015mol,
所以完全溶解后溶液中含有Fe2+为0.015mol×3×$\frac{1}{3}$=0.015mol,加入K2Cr2O7溶液25ml,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化成Cr3+,令K2Cr2O7的物质的量浓度为cmol/L,则:
25×10-3L×cmol/L×2×(6-3)=0.015mol×1
解得:c=0.1
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析、计算能力的考查,难度中等,涉及两步反应,利用方程式计算比较麻烦,关键抓住氧化还原反应中电子转移守恒计算.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 还原性:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现需90mL1.0mol/LNaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 | |
| B. | 测定溶液 pH的实验中,用润湿的pH试纸测定新制氯水的pH--测定结果偏高 | |
| C. | 中和热实验测定中,缓慢地将NaOH溶液倒入测定装置中--对测定结果无影响 | |
| D. | 酸碱中和滴定实验中,标准液滴定前无气泡而滴定后有气泡--测定结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
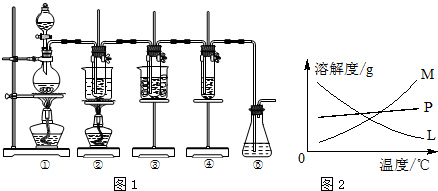
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为11NA | |
| C. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-CH2-CH2-CH3和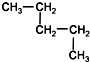 | B. | 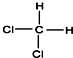 和 和 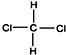 | ||
| C. | CH3-CH3和CH3-CH2-CH3 | D. | 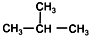 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com