
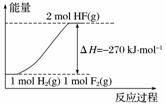
已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是( )
A.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用右图来表示
科目:高中化学 来源: 题型:
原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4溶于水会使溶液温度升高,热效应为ΔH2;CuSO4(s)·5H2O(s)受热分解的化学方程式为CuSO4·5H2O(s)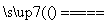 CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A.ΔH2>ΔH3
B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2
D.ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)[2014·四川理综,11(3)]已知:25 ℃、101 kPa时,Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是__________________。
(2)[2014·浙江理综,27(3)]煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g)
ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)CaS(s)+4CO2(g)
ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。
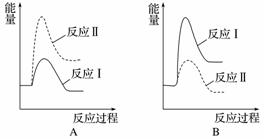
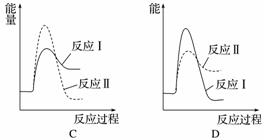
(3)[2014·广东理综,31(1)]用CaSO4代替O2与燃料CO反应,既可提高燃料效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)
ΔH2=+210.5 kJ·mol-1
③CO(g)1/2C(s)+1/2CO2(g)
ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=__________(用ΔH1、ΔH2和ΔH3表示)。
(4)[2014·大纲全国卷,28(1)]化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为____________________________________。
(5)[2014·天津理综,7(4)]晶体硅(熔点1 410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
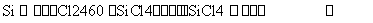
写出SiCl4的电子式:______;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1②X(g)—→C(g) ΔH2,反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是( )
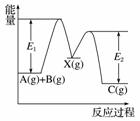
A.ΔH1=ΔH-ΔH2>0
B.X是反应A(g)+B(g)—→C(g)的催化剂
C.E2是反应②的活化能
D.ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于SiO2和CO2的说法中正确的是( )
A.CO2、SiO2分别是碳酸和硅酸的酸酐
B.CO2和SiO2与水反应分别生成相应的酸
C.CO2是酸性氧化物,SiO2是两性氧化物
D.CO2和SiO2都是由相应的分子组成的
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.利用高纯硅可以制成光电池,将光能直接转化为电能
B.CO、CO2均易与血红蛋白结合而中毒
C.在SiO2制备高纯硅的过程中只涉及置换反应
D.SiO2和H2O反应可直接制备H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持及加热仪器已略)。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关反应的化学方程式为__________________________。
装置B中饱和食盐水的作用是____________________。
同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:______________________________________________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入的物质为________(填字母)
| 选项 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入少量氯气时,可以看到无色溶液逐淅变为________色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是__________________________________。
(4)装置F中用足量的Na2SO3溶液吸收多余氯气,试写出相应反应的离子方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com