
| A. | 光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色 | |
| B. | 乙烷在氧气中燃烧;乙烯在氧气中燃烧 | |
| C. | 乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色 | |
| D. | 工业上由乙烯和水反应生成乙醇;乙烯能使酸性高锰酸钾溶液褪色 |
分析 A.光照下发生取代反应,乙烯与溴水发生加成反应;
B.燃烧为氧化反应;
C.能使溴水褪色,为加成反应,而使酸性高锰酸钾溶液褪色为氧化反应;
D.乙烯和水发生加成反应制乙醇,乙烯与高锰酸钾发生氧化反应.
解答 解:A.光照下发生取代反应,乙烯与溴水发生加成反应,反应类型不同,故A不选;
B.燃烧为氧化反应,反应类型相同,故B选;
C.能使溴水褪色,为加成反应,而使酸性高锰酸钾溶液褪色为氧化反应,反应类型不同,故C不选;
D.乙烯和水发生加成反应制乙醇,乙烯与高锰酸钾发生氧化反应,反应类型不同,故D不选.
故选B.
点评 本题考查有机物的结构与性质,侧重有机反应类型的考查,熟悉烯烃、烷烃的性质及常见有机反应类型即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.5 摩1,3-丁二烯分子中含有共价键数为5.5N0 | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9N0 | |
| C. | 1 mol-OH和1 mol OH-所含电子数都为9N0 | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为8N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4.2g乙烯和丙烯的混合气体中含有的非极性键总数为0.6NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜 | |
| C. | 在含有CH3COO-为1.0 mol•L-1的醋酸溶液中,H+数目略大于NA | |
| D. | V L a mol•L-1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
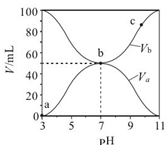
| A. | Ka(HA)=10-6 mol•L-1 | |
| B. | b 点时,c(B+)=c(A-)=c(H+)=c(OH-) | |
| C. | c 点时,$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$随温度升高而减小 | |
| D. | a→c 过程中水的电离程度始终增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
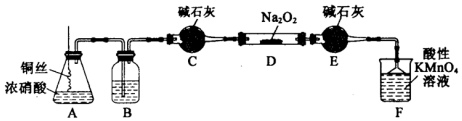
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMn04溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图I研究的是温度对反应的影响,且乙的温度较高 | |
| B. | 图Ⅱ研究的是压强对反应的影响,且甲的压强较高 | |
| C. | 图III研究的是温度对反应的影响,且乙的温度较低 | |
| D. | 图IV研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
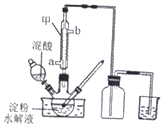 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取、性质及应用,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取、性质及应用,进行如下实验.| 编号 | H2C2O4溶液 | 酸性高锰酸钾溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-l | 体积/mL | ||
| 甲 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| 乙 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| 丙 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com