
| A. | K+、Na+、NO3-、MnO4- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | K+、Cu2+、Br-、S2- | D. | NH4+、Al3+、Ac-、NO3- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
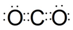 ;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.
;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的NaHCO3溶液的碱性大于NaClO溶液 | |
| B. | 图象中a点的导电能力小于c点 | |
| C. | 图象 I代表CH3COOH溶液的稀释 | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
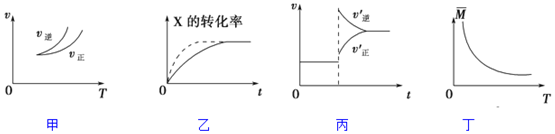
| A. | 依据图甲可判断正反应为吸热反应 | |
| B. | 在图乙中,虚线可表示压强增大 | |
| C. | 若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动 | |
| D. | 由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①③ | C. | ①②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有12mol(NH4)2SO4分解 | B. | 有6mol原子被还原 | ||
| C. | 生成2mol氧化产物 | D. | 生成7molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
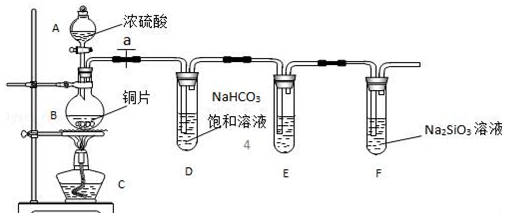
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com