
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
分析 短周期元素,由元素的化合价可知,D、E都有-2价,而D有+6价且原子半径较大,则D为S、E为O元素;A、B、C化合价分别为+1、+3、+2,则分别处于IA族、ⅢA族、ⅡA族,C的原子半径小于硫,故C为Be元素,原子半径A、B均大于硫,则B为Al,且A、B原子半径相差较大,故A为Na,结合元素周期律解答.
解答 解:(1)A、B、D、E分别为Na、Al、S、O,离子的电子层越多,离子半径越大,离子的电子层相同时,核电荷数越大,离子半径越小,则离子半径大小为:S2->O2->Na+>Al3+,
故答案为:S2->O2->Na+>Al3+;
(2)B单质(Al)和C单质(Be)的化学性质相似,则Be与强碱溶液反应生成Na2BeO2和H2,反应的离子方程式为:Be+2OH-=BeO22-+H2↑,
故答案为:Be+2OH-=BeO22-+H2↑;
(3)D为S、E为O,D和E组成的两种化合物中具有漂白性的是SO2,二者形成的另一种化合物为SO3,二氧化硫催化氧化生成三氧化硫,反应的化学方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3 ,
故答案为:SO2;2SO2+O2$?_{△}^{催化剂}$2SO3 ;
(4)A的氢化物能为NaH,NaH与水反应生成一种可燃性气体和一种强碱,可燃性气体为氢气,强碱为NaOH,反应的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,B为难点,注意类比法的应用.


科目:高中化学 来源: 题型:解答题
| t/s | 0 | 30 | 150 | 250 | 350 | 450 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓氨水中加固体NaOH | B. | 混合NH4Cl溶液和NaOH溶液 | ||
| C. | 加热分解NH4Cl晶体 | D. | 加热消石灰和NH4NO3的固体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、氯化钠、氨气、干冰 | B. | 碳酸、氯化钠、乙酸、冰 | ||
| C. | 草酸、碳酸氢钠、氯化钠、碳酸钙 | D. | 硫酸、硫酸钡、醋酸铵、胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的最简式:C6H6 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 2-乙基-1,3-丁二烯分子的键线式: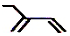 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com